
下列各组离子一定能大量共存的是( )
A.在含有大量[Al(OH)4]-的溶液中:NH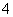 、Na+、Cl-、H+
、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO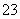 、NO
、NO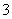
C.在pH=12的溶液中:NH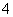 、Na+、SO
、Na+、SO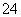 、Cl-
、Cl-
D.在[H+]=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO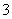
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知: ① C(s)+O2(g) CO2(g)
CO2(g)
ΔH1=-393.5kJ·mol-1
② CO(g)+O2(g) CO2(g)
CO2(g)
ΔH2=-283.0kJ·mol-1
则: ③ C(s)+O2(气) CO(g)
CO(g)
ΔH3 = kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL浓度为2mol·L-1的盐酸与过量的锌片反应,为增大反应速率,又不影响生成氢气的总量,可采用的方法是()
A. 加入适量的6mol·L-1的盐酸
B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水
D. 加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是)
A. 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B. 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C. 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的正极反应不同
D. 无论哪种类型的金属腐蚀,其实质都是金属被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸。
(1)当其物质的量浓度相同时,[H+]由大到小的顺序是______________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是____________。
(3)当其[H+]相同时,物质的量浓度由大到小的顺序为______________。
(4)当其[H+]相同、体积相同时,分别加入足量锌,相同状况下产生气体的体积由大到小的顺序为_________________________________________________________________。
(5)当[H+]相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率________,反应所需时间__________。
(6)将[H+]相同的三种酸均稀释10倍后,[H+]由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表面上镀有金属保护层的铁板,当镀层损坏使铁板裸露后,在相同条件下最耐腐蚀的是( )
A.镀锌铁板(白铁) B.镀锡铁板(马口铁)
C.镀银铁板 D.镀铜铁板
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-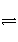
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
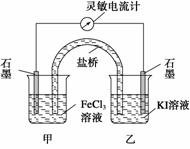
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
A.甲烷和氯气混合后光照发生反应
B.乙烯与氯化氢的加成反应
C.甲苯与等物质的量的Br2发生反应
D.乙炔和氯气的加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com