
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);3Fe
2SO3(g);3Fe (s)+4H2O(g)
(s)+4H2O(g) Fe3O
Fe3O 4(g)+4H2(
4(g)+4H2( g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
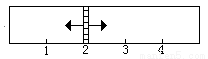
(1)若x=1.5,则左侧反应在起始时向__________(填“正”或“逆”)反应方向进行。欲使反应维持向该方向进行,则x的取值范围是______________。
(2)若x=2,平衡时混合气中SO2所占的体积分 数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
数为______________。欲使起始反应维持向该方向进行,则x的最大值应小于____________。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
将4.3gNa,Na2O,Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比
A.1:2:1 B.1:1:1 C.1:3:1 D.4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1表示KNO3的溶解度曲线,图中a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示反应aA(g)+bB(g)?cC(g)表示改变某一条件对化学平衡的影响,若p1>p2 此反应自发进行,必须满足的条件是低温 | |
| D. | 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | N2 | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
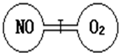 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.已知2NO+O2═2NO2,打开活塞,使NO与O2充分反应,则下列说法错误的是( )| A. | 开始时左右两室分子数相同 | B. | 反应开始后NO室压强减小 | ||
| C. | 最终容器内密度与原来相同 | D. | 最终容器内仍然有O2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B一定都是气体 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
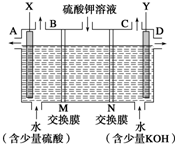 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com