
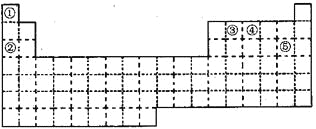
【题目】①~⑤五种元素在元素周期表中的位置如下图所示:
回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是___________;
(2)②③④元素原子中,半径最小的是_________(填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是_____(化学式)。该化合物中,化学键的类型为_________(选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元素④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是________(化学式);
(5)元素⑤单质与水反应的离子方程式:________________________________。
【答案】第三周期第VIIA族 N CH4 极性共价键 NH4NO3 Cl2+H2O=H++Cl-+HClO
【解析】
根据元素在周期表中的位置,可以知道①②③④⑤分别是H、Na、C、N、Cl元素,
(1)同周期自左而右元素的非金属性逐渐增强,同主族自上而下元素的非金属性逐渐减弱,所以这几种元素中非金属性最强的是Cl元素;
(2)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
(3)元素①和③可以形成众成多的化合物,其中最简单的是CH4;
(4)元索④的最高价氧化物对应水化物为硝酸,其最低价的气态氢化物为氨气,二者反应生成硝酸铵;
(5)氯气和水反应生成HCl和HClO。
根据元素在周期表中的位置,可以知道①②③④⑤分别是H、Na、C、N、Cl元素,
(1)同周期自左而右元素的非金属性逐渐增强,同主族自上而下元素的非金属性逐渐减弱,所以这几种元素中非金属性最强的是Cl元素,Cl元素处于第三周期ⅦA族;因此,本题正确答案是:第三周期ⅦA族;
(2)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,故原子半径:Na>C>N,因此,本题正确答案是:N;
(3)元素①和③可以形成众成多的化合物,其中最简单的是CH4;甲烷属于共价化合物,存在极性共价键;因此,本题正确答案是:CH4;极性共价键;
(4)元索④的最高价氧化物对应水化物为HNO3,其最低价的气态氢化物为NH3,二者反应生成NH4NO3;因此,本题正确答案是:NH4NO3;
(5)氯气和水反应生成HCl和HClO,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO;因此,本题正确答案是:Cl2+H2O=H++Cl-+HClO。


科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
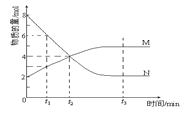
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
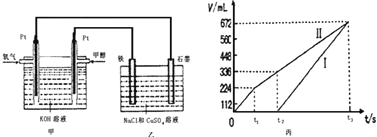
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼![]() 又称联氨,是一种可燃性的液体,可用作火箭燃料。
又称联氨,是一种可燃性的液体,可用作火箭燃料。
![]() 已知在101kPa时,
已知在101kPa时,![]() 时,
时,![]() 在氧气中完全燃烧生成氮气和水,放出624kJ的热量,则
在氧气中完全燃烧生成氮气和水,放出624kJ的热量,则![]() 的燃烧热的热化学方程式是_____________。
的燃烧热的热化学方程式是_____________。
![]() 下图是一个电化学过程示意图。
下图是一个电化学过程示意图。

![]() 图中甲池是_________
图中甲池是_________![]() 填“原电池”或“电解池”
填“原电池”或“电解池”![]() ,其电解质溶液为KOH溶液,则该池电极M的电极反应式是_________________________。
,其电解质溶液为KOH溶液,则该池电极M的电极反应式是_________________________。
![]() 乙池中石墨电极2的电极反应式是_________________________。 当石墨电极2上生成
乙池中石墨电极2的电极反应式是_________________________。 当石墨电极2上生成![]() 气体时
气体时![]() 标准状况下
标准状况下![]() ,转移的电子的数目为_________,则甲池理论上消耗标标准状况下的空气是________
,转移的电子的数目为_________,则甲池理论上消耗标标准状况下的空气是________![]() 假设空气中氧气体积含量为
假设空气中氧气体积含量为![]() 。
。
![]() 传统制备肼的方法,是以NaClO氧化
传统制备肼的方法,是以NaClO氧化![]() ,制得肼的稀溶液。该反应的离子方程式是_________。
,制得肼的稀溶液。该反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
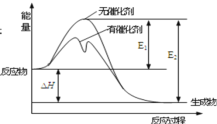
A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
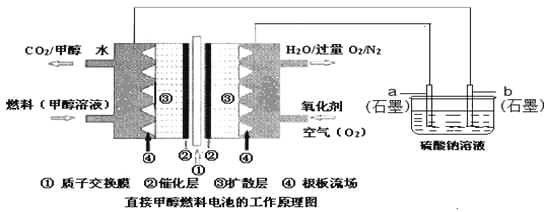
请根据图示回答下列问题:
(1)图中a电极是______(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为_________________________________________。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为____________________________。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是__。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是

A. b电极反应式为2H++2e-=H2↑B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=CuD. 铜电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq)![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A. n (Ca2+)增大 B. c(Ca2+)不变
C. c(OH-)增大 D. n(OH-)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com