
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
分析 由三种元素基态原子电子排布式可知,①C元素、②N元素、③O元素.
A.同周期随原子序数增大,元素第一电离能层增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
B.同周期自左而右原子半径减小;
C.同周期自左而右,元素电负性增强;
D.最高正化合价等于最外层电子数,但O元素没有正化合价.
解答 解:由三种元素基态原子电子排布式可知,①C元素、②N元素、③O元素.
A.同周期随原子序数增大,元素第一电离能层增大趋势,但N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:②>③>①,故A正确;
B.同周期自左而右原子半径减小,故原子半径:①>②>③,故B错误;
C.同周期自左而右,元素电负性增强,故电负性:③>②>①,故C错误;
D.最高正化合价等于最外层电子数,但O元素没有正化合价,故最高正化合价:②>①>③,故D错误,
故选A.
点评 本题考查核外电子排布、元素周期律,比较基础,注意同周期元素第一电离能异常情况.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
A、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的 转化率
转化率
B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C、在实验室里,可用碳酸钙粉末和稀盐酸制得二氧化碳气体;
D、实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:
CH4(g)+2NO2(g) N2(
N2( g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,达平衡时CH4 的转化率大于NO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
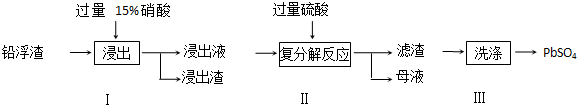
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(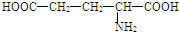 )间缩合可形成二肽 )间缩合可形成二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
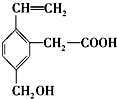
| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(其它无机物任选)
.(其它无机物任选)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸式滴定管量取20.0mL酸性高锰酸钾溶液 | |
| B. | 用米汤直接检验食盐中是否有碘元素 | |
| C. | 用酚酞检验纯碱中是否含有烧碱 | |
| D. | 多次盐析或多次渗析的方法分离提纯蛋白质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com