
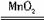
(1)制SO2(氧化还原反应) ;制SO2(复分解反应) 。
(2)制HCl的化学方法: ;制HCl的物理方法:烧瓶中盛 ,分液漏斗中盛 。
(3)如果撤去酒精灯,此装置可用于制H2、CO2、H2S及O2,如果用于制O2,烧瓶中盛 ,分液漏斗中盛 ,所发生反应的化学方程式为 。
解析:(1)浓H2SO4具有强氧化性,与Cu或木炭粉在加热条件下反应被还原为SO2,因此可用浓H2SO4的氧化性来制取SO2。H2SO3不稳定,在加热条件下易分解,可通过强酸制弱酸得到H2SO3,再加热使其分解制SO2。
(2)实验室制取HCl是利用浓H2SO4的高沸点性,NaCl与浓H2SO4在加热条件下制得HCl气体。物理方法制HCl是利用了浓盐酸的挥发性,浓H2SO4吸水有利于HCl的溢出(注意浓H2SO4与其他液体混合时一般是向其他液体中慢慢滴加浓H2SO4)。
(3)实验室制O2是固体与固体在加热条件下的反应,而题目要求撤去酒精灯,因此不能用实验室方法来制取。本题可利用H2O2的不稳定性,易分解来制取O2。
答案:(1)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
Na2SO3+H2SO4 ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
(2)NaCl+H2SO4(浓) ![]() NaHSO4+HCl↑
NaHSO4+HCl↑
浓盐酸 浓H2SO4
(3)MnO2 H2O2 2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑


科目:高中化学 来源: 题型:
已知:①NO+NO2+2OH-====2![]() +H2O;气体液化温度:NO2为21 ℃;NO为-152 ℃。
+H2O;气体液化温度:NO2为21 ℃;NO为-152 ℃。
试完成下列问题:
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B;乙:A→B→C→E;丙:A→F→D→B;甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓硝酸反应产生的气体中含有NO?
甲________;乙________;丙________。(填“能”或“不能”)具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答)。
(2)反应前先通入足量的N2,其目的是_________________________________。
(3)确认气体中含有NO的现象是______________________________________。
(4)如果O2过量,则装置B中发生反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
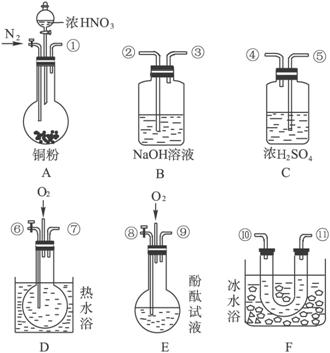
(8分)相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期。在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A。实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略)。
(1)制取X、Z、M的发生装置分别是(填写序号)X:________;Z:________;M:________。
(2)X、Y、Z三种单质分别是X:________;Y:________;Z:________。
(3)A的电子式是________,A中含有的化学键类型有__________________。
(4)已知Z能与M在常温下反应生成Y,同时有白烟产生。反应的化学方程式是________________________________________________________________________。
用下图所示装置进行Z与M在常温下反应的实验,并收集Y。
①若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足________。
②若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是__________________;__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
探究苯和溴的取代反应,甲用如下图所示的装置Ⅰ进行如下实验:
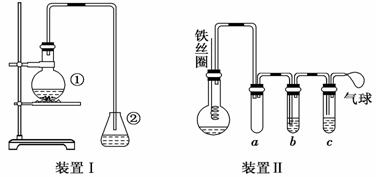
将一定量的苯与溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯和溴发生了取代反应。
(1)装置I中①的化学方程式为
_______________________________________________________,
_______________________________________________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是___________________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
查看答案和解析>>
科目:高中化学 来源:2015届山东省莱芜市高一上学期期末考试化学试卷(解析版) 题型:填空题
(14分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
Ⅰ.若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
装置 A B C D
试剂 FeCl2溶液 淀粉KI溶液 石蕊溶液
现象 溶液由浅绿色变为棕黄色
离子方程式
II.若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液)。
|
装置 |
A |
B |
C |
|
试剂 |
品红溶液 |
酸性高锰酸钾溶液 |
硫化氢的水溶液 |
|
现象 |
|
紫色退去 |
|
|
体现SO2的性质 |
|
|
氧化性 |
(1)写出C中发生反应的化学方程式 。
(2)D装置中用氢氧化钠溶液来吸收SO2,为了防止倒吸,应该选用下列装置中的 (填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com