


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、该反应属于氧化还原反应 |
| B、反应中NH3表现强氧化性 |
| C、生成28gN2有6mol电子转移 |
| D、反应后Cl2被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| D |
| ① |
| D |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | R | |
| 主要化合物 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A、非金属性:Z<R<Y |
| B、T与R可以形成化合物TR2 |
| C、X与R的单质均能使品红溶液褪色 |
| D、T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是一种白色晶体,其酸及盐均为强氧化剂.
是一种白色晶体,其酸及盐均为强氧化剂.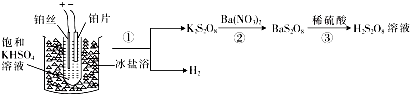
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C 原子基态时最外层电子数是其内层电子总数的2倍 |
| ④ | D 原子核外占有9个轨道,且只有1个未成对电子 |
| ⑤ | E、X、Y三种元素处于第4周期;E元素的正三价离子的3d亚层为半充满,X元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;Y元素原子的4p轨道上有3个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
. |
. |

查看答案和解析>>
科目:高中化学 来源: 题型:
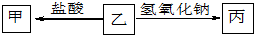
| 甲 | 乙 | 丙 | |
| A | AlCl3 | Al | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | NaCl | NaHCO3 | Na2CO3 |
| D | CO2 | (NH4)2CO3 | NH3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com