
【题目】水是生命的源泉、工业的血液、城市的命脉。河水01是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和溉溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1molL-1的NaOH溶液中,由水电离出的c(OH-)=___molL-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___。
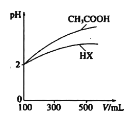
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___(填“大于”或“小于”或“等丁”)CH3COOH的电离平衡常数,理由是___。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
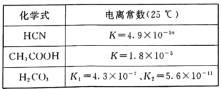
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为____。
②向NaCN溶液中通人少量的C02,发生反应的化学方程式为___。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH = 6,则溶液中c(CH3COO-)-c(Na+)=___molL-1(填精确值)。
【答案】10-12mol·L-1。 CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH- 小于 稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
H2CO3+OH- 小于 稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小 pH(Na2CO3溶液)>pH(NaCN溶液)>pH(CH3COONa溶液) NaCN+H2O+CO2=HCN+NaHCO3 9.9×10-7
【解析】
(1)纯水在100℃时,Kw=10-12,1mol·L-1的NaOH溶液中由水电离出的c(OH-)等于溶液中的c(H+);
(2)碳酸钠为强碱弱酸盐,溶液呈碱性,碳酸钠的水解反应分步进行,以第一步为主;
(3)根据图像可知,稀释相同体积时,HX的pH变化量比醋酸的小;
(4)强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小。
(5)25℃时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)计算。
(1)纯水在100℃时,pH=6,即c(H+)=c(OH-)=10-6mol·L-1,可知Kw=10-12,1mol·L-1的NaOH溶液中由水电离出的c(OH-)等于溶液中的c(H+),即c水电离(OH-)=c(H+)=10-12mol·L-1。
(2)碳酸钠为强碱弱酸盐,溶液呈碱性,碳酸钠的水解反应分步进行,以第一步为主,则电离方程式为CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)根据图像可知,稀释相同体积时,HX的pH变化量比醋酸的小,则HX的酸性较弱,电离平衡常数较小;
(4)强碱弱酸盐对应的酸的酸性越弱,其水解程度就越大,pH越大,弱酸的电离平衡常数越小。
①25℃时,根据表中数据可知,酸性:CH3COOH>HCN>HCO3-,则溶液的pH由大到小的顺序为Na2CO3溶液、NaCN溶液、CH3COONa溶液;
②K2小于K(HCN),K1大于K(HCN),因此向NaCN溶液中通入少量的CO2,产物应是NaHCO3,反应的方程式为NaCN+H2O+CO2=HCN+NaHCO3;
(5)25℃时,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液的pH=6,则c(H+)=10-6mol/L,c(OH-)=10-8mol/L,故c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7mol/L。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
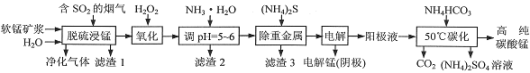
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
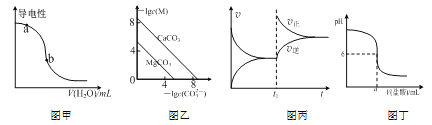
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b)
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙表示一定温度下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
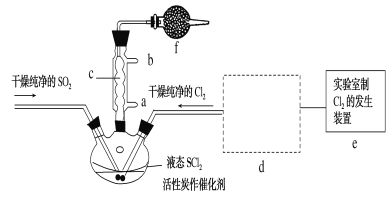
(1)下列四种制备SO2的方案中最佳选择是__。
方案 | A | B | C | D |
发生装置 |
|
|
|
|
所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变
B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺(N(CH3)2NCHO,简称DMF)转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
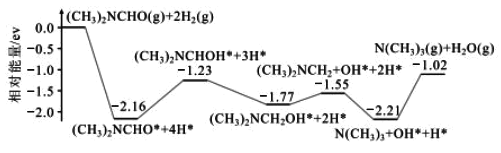
该历程中最大能垒(活化能)=__eV,该步骤的化学方程式为__。
(2)该反应变化的ΔH__0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__(Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__(填“a→b”或“b→a”),负极的电极反应式为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
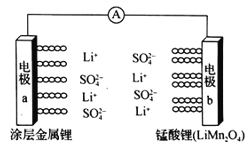
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com