
 .
. 分析 (1)将生成的气体依次通过CaCl2管(A)和碱石灰(B),A管质量增加了2.16g,应为水的质量,B管增加了9.24g,应为二氧化碳的质量,根据有机物的相对分子质量可知一定物质的量的有机物中含有的C、H原子个数,结合质量守恒计算是否含有O,并计算O原子个数;
(2)结合有机物的性质判断可能的结构;苯环上的一溴代物最少,则取代基具有对称结构,据此写出满足条件的有机物的结构简式.
解答 解:(1)浓硫酸吸水质量增加2.16g,即生成水的物质的量为:$\frac{2.16g}{18g/mol}$=0.12mol,含H的物质的量为0.24mol,
碱石灰吸CO2增加9.24g,即生成二氧化碳的物质的量为:$\frac{9.24g}{44g/mol}$=0.21mol,
该有机物物质的量为:$\frac{3.24g}{108g/mol}$=0.03mol,
该有机物分子中含有C、H的原子数为:N(C)=$\frac{0.21mol}{0.03mol}$=7、N(H)=$\frac{0.24mol}{0.03mol}$=8,
根据相对分子质量判断,还应含O个数为:$\frac{108-12×7-1×8}{16}$=1,
所以有机物的分子式为:C7H8O,
故答案为:C7H8O;
(2)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,说明分子中含有1个-OH,可能为苯甲醇或甲基苯酚,苯甲醇只有1种结构,甲基苯酚存在邻、间、对3种结构: 、
、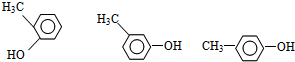 ,所以满足条件的有机物总共有4种结构;
,所以满足条件的有机物总共有4种结构;
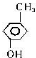
苯环上一溴取代同分异构种类最少,说明苯环上含有的甲基和酚羟基处于对位,即:该有机物为对甲基苯酚: ,
,
故答案为:4; .
.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,本题注意根据有机物燃烧产物的质量关系确定有机物的分子式,为解答该题的关键,注意结合有机物的性质判断可能的结构.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:解答题
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
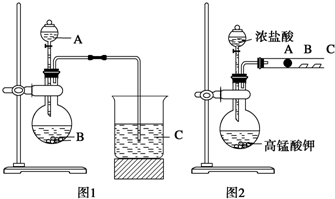
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
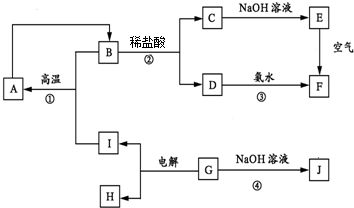
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
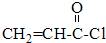 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3 .(注明反应条件)
.(注明反应条件) 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.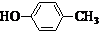 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为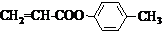 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 6:3:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com