
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17.
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是
(2)Y是 ,Z是 ,W是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.写出该化合物的名称及化学式 .
考点: 位置结构性质的相互关系应用.
专题: 元素周期律与元素周期表专题.
分析: (1)若Y、Z、W三者处于同一周期,最外层电子数之和不可能为17.
(2)列出可能的位置关系,利用最外层电子数之和为17推断.
(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,为铵根离子.
解答: 解:(1)假设Y、Z、W处于同一周期,根据它们的原子序数依次增大,其最外层电子数分别设为x﹣1、x、x+1,则x﹣1+x+x+1=17,x为分数,不合理,假设不成立.
故答案为:否,若三者处于同一周期,则最外层电子数之和不可能为17;
(2)处于不同周期的Y、Z、W两两相邻,可能出现的位置关系有:
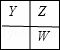

设Y的最外层电子数为x,若为第一种情况,则有x+x+1+x+1=17,解得x=5,Y、Z、W对应的三种元素分别为N,O,S;若为第二种情况,则有x+x+x+1=17,x为分数,不合理.
故答案为:N;O;S;
(3)化合物中硫原子与氧原子个数之比为1:4,为硫酸根,化合物中x原子与氮原子个数之比为4:1,且x的原子序数比氮原子小,为铵根离子,所以该化合物为硫酸铵,
其化学式为(NH4)2SO4,
故答案为:硫酸铵 (NH4)2SO4.
点评: 本题考查学生对元素结构与位置性质关系的利用,难度不大,关键在确定元素Y、Z、W的可能位置,利用最外层电子数之和为17推断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒用作引流的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 78 gNa2O2晶体中所含阴阳离子个数均为2NA
B. 1.5 g CH3+中含有的电子数为NA
C. 3.4 g氨气分子中含有0.6NA个N﹣H键
D. 常温下,100 mL1 mol•L﹣1AlCl3溶液中Al3+离子总数等于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2.当0.2mol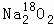 与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
与足量CO2完全反应后,如表所示对生成物Na2CO3和O2的描述中正确的是( )
选项 Na2CO3的质量 关于O2的描述
A 21.2g O2的摩尔质量是36g•mol﹣1
B 21.6g 生成标准状况下O2的体积为2.24L
C 21.6g O2的摩尔质量是34g•mol﹣1
D 22.4g 生成标准状况下O2的体积
为2.24mL
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2、H2S、NH3、HCl分别收集于等体积的四个容器中,用导管把四个容器连成一个整体,若使各种气体充分混合(前后条件均相同),混合后容器中的压强与原容器中的压强之比为( )
A. 1:1 B. 1:2 C. 3:4 D. 1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于燃烧热的说法中正确的是()
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O2⇌2SO3,经过一段时间后,O2的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4mol/(L•s),则这段时间为()
A. 0.1 s B. 2.5 s C. 5 s D. 10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
有三支试管,分别加入下列物质后甲:10mL 0.01mol/L FeCl3溶液和10mL 0.01mol/L KSCN溶液乙:5mL水、10mL 0.01mol/L FeCl3溶液5mL 0.01mol/L KSCN溶液丙:10mL 0.1mol/L FeCl3溶液和10mL 0.1mol/L KSCN溶液观察这三支试管的颜色,其中颜色最浅的是()
A. 甲试管 B. 乙试管 C. 丙试管 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,能证明某物质是强电解质或弱电解质的是( )
|
| A. | 某物质熔化时不导电,则该物质为弱电解质 |
|
| B. | 某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质 |
|
| C. | 某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸 |
|
| D. | 溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com