
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
科目:高中化学 来源: 题型:解答题
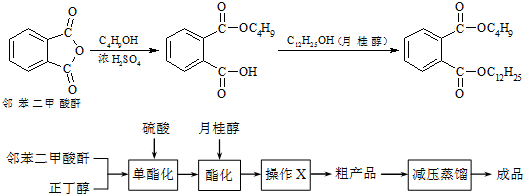
| 化合物 | 溶解性 | 熔点 | 沸点 |
| 邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
| 正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
| 月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
| 邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
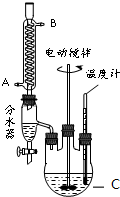
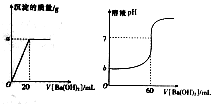 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
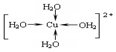 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
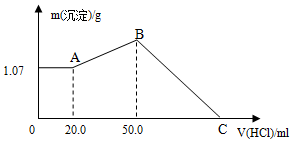 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com