
【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1
【答案】B
【解析】
Na2CO3和NaHCO3固体混合物中滴加盐酸,开始没有气体生成,发生的反应为CO![]() +H+=HCO
+H+=HCO![]() ,再加盐酸,开始有气体生成,发生的反应为HCO
,再加盐酸,开始有气体生成,发生的反应为HCO![]() + H+=CO2
+ H+=CO2![]() +H2O,由表格可知,气体体积为672mL时反应结束。
+H2O,由表格可知,气体体积为672mL时反应结束。
A.根据分析,实验1中尚未出现气体,故发生的反应为CO![]() +H+=HCO
+H+=HCO![]() ,A正确,不选;
,A正确,不选;
B.实验2已经开始生成气体,溶液中没有Na2CO3,B错误,符合题意;
C.通过表格中生成的气体量,可以推断实验3和实验4已经反应完,溶液中有NaCl和HCl,蒸干后只剩NaCl,C正确,不选;
D.设Na2CO3的物质的量为x,NaHCO3的物质的量为y,672mlCO2的物质的量为![]() ,根据题意可得
,根据题意可得
![]() ,解得
,解得![]() ,故Na2CO3和NaHCO3的物质的量之比为2:1,D正确,不选;
,故Na2CO3和NaHCO3的物质的量之比为2:1,D正确,不选;
故选B。


科目:高中化学 来源: 题型:
【题目】气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+BaC+2D,经5 min后,此时C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A.A的平均反应速率为0.1 mol·(L·min)-1B.a值为2
C.B的转化率为50%D.此时,反应混合物总的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出NaHSO4溶液的电离方程式_____; 写出Na2CO3水解的离子方程式_____ ;
(2)25℃时,pH= a的NaOH溶液中, 溶液的C(OH-) =_____ mol/L。
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是______。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是_____。
③若三者pH相同且体积相等,中和NaOH的能力由大到小的顺序是________。
(4)有下列盐溶液:①MgCl2 ②KNO3 ③KClO ④CH3COONH4 ⑤NaCN⑥Fe2(SO4)3,呈酸性的是________,呈碱性的是________,呈中性的是________(用相应的序号填写)。
(5)请写出明矾(K Al(SO4)212H2O)做净水剂净水时的离子方程式____________;
(6)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的离子方程式:____________;
(7)物质的量浓度相同的 氯化铵;②碳酸氢铵;③ 硫酸氢铵;④硫酸铵4种溶液中,c(![]() )由大到小的顺序是_____ (请用相应的序号填写)
)由大到小的顺序是_____ (请用相应的序号填写)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
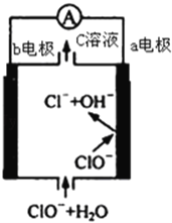
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属元素,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )
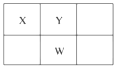
A.Z的最高价氧化物对应的水化物不可能显弱碱性
B.Y的简单阴离子比W的简单阴离子的还原性弱
C.元素Z、W、Q中原子半径最大的是Q
D.W的最高价氧化物对应的水化物浓溶液加热时不可能与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
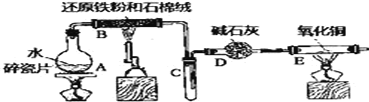
(1)装置B中发生反应的化学方程式是_______________________.
(2)D的作用是________。点燃E处酒精灯之前应进行的操作是_________。E中出现的现象是__________.
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体.
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是_____________.
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因:_______________.
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的___________.
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
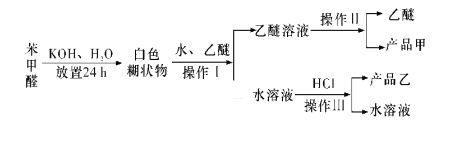
A.操作Ⅰ是萃取分液
B.操作Ⅱ蒸馏得到的产品甲是苯甲醇
C.操作Ⅲ过滤得到的产品乙是苯甲酸钠
D.乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是
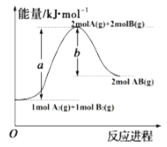
A.AB(g)中的键能是0.5bkJ·mol-1
B.该反应是放热反应
C.该反应的热化学方程式为:A2(g)+B2(g)=2AB(g)△H=-(a-b)kJ·mol-1
D.每生成1molA2和1molB2,放出akJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com