
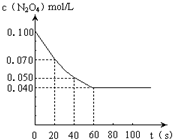
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)| 消耗量 |
| 起始量 |
| 0.07mol/L-0.05mol/L |
| 20s |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| 0.122 |
| 0.04 |
| 0.06mol/L |
| 0.100mol/L |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能发生加聚反应 |
| B、氟氯代烷(氟利昂)有毒、性质不稳定、不易挥发,目前常用作制冷剂且对环境无影响 |
| C、甲烷中含乙烯杂质可以用酸性高锰酸钾溶液除去 |
| D、石油分馏是物理变化,煤干馏是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表中一共有18个纵行 |
| B、原子最外层电子数为2的元素全部位于周期表的第ⅡA族和零族 |
| C、同周期第ⅡA族与第ⅢA族元素的原子序数之差可能为25 |
| D、同主族两种元素的原子序数之差可能为44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com