
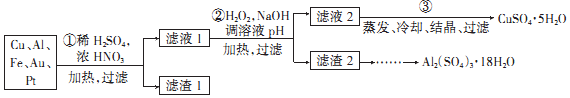
分析 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4•5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,以此解答(1)-(2);
(3)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(4)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以由EDTA的物质的量可求出CuSO4•5H2O的物质的量,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,可得样品中CuSO4•5H2O的物质的量,进而求出CuSO4•5H2O的含量.
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,Cu与酸反应的离子方程式为Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣是Au、Pt;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染;调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+生成沉淀;
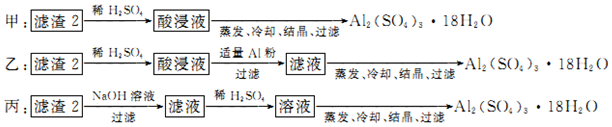
(3)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙最合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行;从原子利用率和是否产生杂质考虑知,乙方案更合理,
故答案为:甲、丙;甲所得产品中含有较多Fe2(SO4)3杂质,丙中含有硫酸钠杂质;乙;
(4)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以CuSO4•5H2O的物质的量为bc×10-3 mol,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,所以样品中CuSO4•5H2O的物质的量为5bc×10-3 mol,则CuSO4•5H2O质量分数为$\frac{5bc×1{0}^{-3}×250}{a}$×100%,
故答案为:$\frac{5bc×1{0}^{-3}×250}{a}$×100%.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程及物质组成、性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 以苯为萃取剂萃取溴水中的溴,分液时应从下口放出苯溶液 | |
| B. | 蒸馏过程时,加热一段时间后,忘加沸石,应停止加热立刻补加 | |
| C. | 分离I2和铁粉的混合物,可加热,利用I2易升华的特性分离 | |
| D. | 配置1mol/L的盐酸,定容后摇匀,液面下降,不影响准确性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为溶有二氧化碳,所以酸雨的pH小于5.6 | |
| B. | 漂白粉是混合物,其成分为次氯酸钠和氯化钠 | |
| C. | 碳铵是常用的化学肥料,与草木灰混合使用效果更好 | |
| D. | 常用的灭火器成分有干冰、四氯化碳、小苏打和硫酸铝等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 电极X上发生氧化反应 | |
| B. | 电极Y上有气体产生 | |
| C. | 接通电路时,电子从电源的负极流出经过溶液后再从正极流 回电源 | |
| D. | 若反应中有0.1mol电子转移则阴极产物的质量为3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水华、赤潮等水体污染与大量排放硫、氮氧化物有关 | |
| B. | 淀粉可以作为阿司匹林、去痛片等药片的黏合材料 | |
| C. | 硅胶常用作袋装食品'瓶装药品的干燥剂 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com