
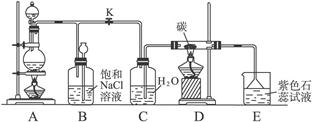
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 4HCl+CO2 提供D处所需的水蒸气
4HCl+CO2 提供D处所需的水蒸气 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 4HCl+CO2。装置C的作用是提供D处所需的水蒸气。
4HCl+CO2。装置C的作用是提供D处所需的水蒸气。

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
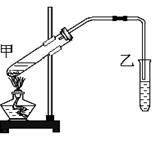
科目:高中化学 来源:不详 题型:单选题
| A.①②③ |
| B.②③④ |
| C.①③④ |
| D.④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
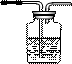
| A.H2→→ |
| B.Cl2 |
| C.H2S |
| D.CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
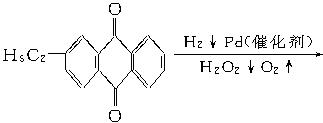
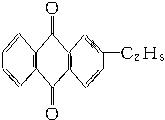

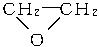 +CaCl2+H2O,则制备
+CaCl2+H2O,则制备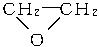 工艺的原子利用率为
工艺的原子利用率为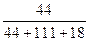 ×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。
×100%。在绿色化学工艺中,原子的利用率为100%的工艺称理想状态的“绿色工艺”。本题提供的生成H2O2的方法,可否称为理想状态的“绿色工艺”?简述理由。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 +4HCl(浓)
+4HCl(浓) MnCl
MnCl +2H
+2H O+Cl
O+Cl ↑。现将4.35 g MnO
↑。现将4.35 g MnO 跟足量36%的盐酸充分反应后,生成的氯气为多少克?
跟足量36%的盐酸充分反应后,生成的氯气为多少克?查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
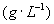 分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于
分别表示溶质在A、B两种溶剂中的浓度,则有c(A)/c(B)=K。对于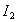 而言,
而言,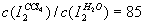 。现有2.0L碘水,其中含
。现有2.0L碘水,其中含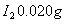 ,若用
,若用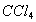 萃取,按两种方法萃取:第一种方法用50mL
萃取,按两种方法萃取:第一种方法用50mL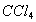 萃取一次;第二种方法是分两次萃取,每次用25mL
萃取一次;第二种方法是分两次萃取,每次用25mL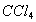 。求两种情况下碘水中残余的
。求两种情况下碘水中残余的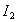 的质量,并指出哪种方法效果好。
的质量,并指出哪种方法效果好。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 物质 | NaCl | KCl | NaClO3 | KClO3 | KOH |
| 价格(元/50kg) | 500 | 1900 | 4200 | 26000 | 10600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com