
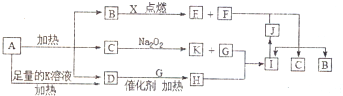
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.分析 短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍,应为Mg元素,A受热分解得到等物质的量的B、C、D三种气态物质,应为NH4HCO3,分解可生成NH3、CO2和H2O,D气体能使湿润的红色石蕊试纸变蓝色,应为NH3,能在B中燃烧的应为CO2和Mg的反应,则C为H2O,B为CO2,K为NaOH,G为O2,H为NO,I为NO2,F为单质,应为C,则E为MgO,J为HNO3,结合物质的性质和题目要求可解答该题.
解答 解:短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍,应为Mg元素,A受热分解得到等物质的量的B、C、D三种气态物质,应为NH4HCO3,分解可生成NH3、CO2和H2O,D气体能使湿润的红色石蕊试纸变蓝色,应为NH3,能在B中燃烧的应为CO2和Mg的反应,则C为H2O,B为CO2,K为NaOH,G为O2,H为NO,I为NO2,F为单质,应为C,则E为MgO,
J为HNO3,则
(1)由以上分析可知B为CO2,电子式为 ,F为C,对应的同素异形体有金刚石、C60、石墨等,D为NH3,为三角锥形结构,
,F为C,对应的同素异形体有金刚石、C60、石墨等,D为NH3,为三角锥形结构,
故答案为: ;金刚石(C60、石墨等);三角锥形;
;金刚石(C60、石墨等);三角锥形;
(2)CO2和Mg反应生成MgO和C,反应的方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)NH4HCO3与足量KOH溶液加热时反应的离子方程式为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,
故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O;
(4)2L的NO气体与0.5L的O2气体相混合,若该混合气体被NaOH溶液恰好完全吸收,反应的方程式为4NO+O2+4NaOH=4NaNO2+2H2O,
故答案为:4NO+O2+4NaOH=4NaNO2+2H2O;
(5)C和HNO3反应被氧化为CO2,同时硝酸被还原为NO2,N元素化合价降低1价,则反应中当转移了1.5mol电子时,生成1.5molNO2,体积为33.6L,
故答案为:33.6.
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的性质可反应的特殊性判断物质的种类,学习中注意积累.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳 | B. | 天然气 | C. | 乙醇 | D. | 氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用淀粉溶液即可检验食盐是否为加碘盐 | |
| B. | 家庭中不宜用铝合金容器长期存放酸性、碱性或咸的食品 | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用脱硫处理的煤代替原煤作燃料可以有效减少空气中SO2气体的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向30mL0.1mol•L-1NaOH溶液滴加20mL0.1mol•L-1H2C2O4溶液后:3c(Na+)=2[c(HC2O${\;}_{4}^{-}$)+c(C2O${\;}_{4}^{2-}$)+c(H2C2O4)] | |
| B. | 将同浓度的CH3COONa溶液和HCl溶液按照体积比2:1混合,混合后溶液呈酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 向NH4HSO4溶液中加入NaOH至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)═c(NH${\;}_{4}^{+}$) | |
| D. | 常温下将pH为3的CH3COOH溶液与pH为11的NaOH溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1某一元弱酸(HA)溶液中:c2(H+)=c(H+)•c(A-)+Kw | |
| B. | 已知Ka(HNO2)=4.6×10-4,Kb(NH3•H2O)=1.8×10-5,可推断NH4NO3溶液呈碱性 | |
| C. | 25℃时,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大后减小 | |
| D. | NH4Cl溶液中滴加NaOH溶液至溶液呈中性时,则有c(Na+)>c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
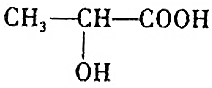 的反应(官能团羟基、羧基,具有醇和酸的性质)
的反应(官能团羟基、羧基,具有醇和酸的性质)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3 | B. | ${\;}_{1}^{2}$H和${\;}_{1}^{2}$H | ||
| C. | 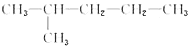 和CH3-CH2-CH2-CH2-CH2-CH3 和CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com