
| A | B | C | D |
 |  |  |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
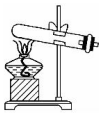
分析 A.混合药品时,应避免酸液飞溅;
B.反应物为液体,应在烧瓶中进行反应;
C.收集乙酸乙酯时,因含有乙酸、乙醇等,应避免液体倒吸;
D.分液时,应保证液体顺利流出.
解答 解:A.混合药品时,应将浓硫酸沿烧杯内壁缓缓倒入烧杯中,以避免酸液飞溅,故A错误;
B.反应物为液体,应在烧瓶中进行反应,该装置适用于固体的加热,故B错误;
C.收集乙酸乙酯时,因含有乙酸、乙醇等,应避免液体倒吸,操作符合要求,故C正确;
D.分液时,应将分液漏斗玻璃塞打开,以保证液体顺利流出,故D错误.
故选C.
点评 本题考查物质的制备、分离,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H3═△H1+2△H2 | B. | △H3═△H1+△H2 | C. | △H3═△H1-2△H2 | D. | △H3═△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的正极 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 该电池放电过程中电解质溶液浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)═c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)═c(Cl-) | |
| C. | 同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+)+c(NH3•H2O)═2c(SO42-) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1 mol•L-1氨水与0.5 mol•L-1氨水中c(OH-)之比是2:1 | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | CH3COOH是弱电解质,NH3•H2O是弱电解质,故CH3COONH4也是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com