
【题目】已知:pKa=-lgKa, 25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20 mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
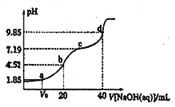
A. a点所得溶液中:c(H2A)>c(HA-) B. b点所得溶液中:c(H2A)+(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-) D. d点所得溶液中A2-水解平衡常数Kh1=10-7.19
【答案】C
【解析】A.根据H2A的pKa1=1.85,所以溶液中c(H2A)=c(HA-),a点溶液中溶质为H2A和NaHA混合物;B. b点酸碱恰好完全反应生成NaHA,溶液显酸性,根据电荷、物料守恒进行处理;C. c点pH=7.19=pKa2,c(A2-)=c(HA-),溶液为NaHA和Na2A混合物;D. A2-水解平衡常数Khl=Kw/Ka2=10-6.81。
用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液,a点溶液中溶质为H2A和NaHA,pH=1.85=pKa1,则c(H2A)=c(HA-),所加氢氧化钠溶液的体积小于10mL,A错误;b点是用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液,恰好反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),B错误;c点pH=7.19=pKa2,Ka2=c(A2)×c(H+)/c(HA)=10-7.19,所以c(A2-)=c(HA-),C正确;A2-水解平衡常数Khl=Kw/Ka2=10-6.81,D错误;正确选项C。


科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为_____________________
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4
空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子________________________(任写一种).
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素第一电离能由小到大顺序为_________________。
(4)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式),_________,理由是________________________________________________________.
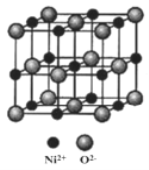
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________________g/cm3(只列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应过程中一定有电子转移
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程失去电子
D.失去电子的反应是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某固体物质中是否铵盐,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②氢氧化钠溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤B.④⑤C.①③D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)![]() 2NO2(g);ΔΗ<0,不能说明已达到平衡状态的是
2NO2(g);ΔΗ<0,不能说明已达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成O2的速率相等
B. 混合气体颜色深浅保持不变
C. 反应器中压强不随时间变化而变化
D. 混合气体平均分子量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子(或在指定条件下)能大量共存的是( )
A. 中性溶液:Na+、Fe3+、Cl-、NO3-
B. NH4+、Na+、NO3-、SiO32-
C. 麦芽糖溶液中:SO42-、MnO4-、K+、H+可以大量共存
D. 0.1mol /LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1, 则可知 C 的热值为 110.5 kJ·mol1
C. 0℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com