
| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
分析 根据题中信息可知,Na2O2与水反应得到的氧气的量可以计算过氧化钠的质量,可以求出氧化钠质量,根据质量分数等于氧化钠质量和混合物质量的比值进行计算即可.
解答 解:设原固体混合物中Na2O2的物质的量为xmolg,已知2H2O+2Na2O2=4NaOH+O2↑,H2O+Na2O=2NaOH;则Na2O2与水反应生成的氧气为0.5xmol,所以0.5x×32g/mol=1.6g,x=0.1mol,质量是7.8g,所以氧化钠的质量是10.4g-7.8g=2.6g,所以混合物中Na20的质量分数为$\frac{2.6g}{10.4g}×100%$≈25%.故选C.
点评 本题考查了Na2O和Na2O2与水的反应,同时涉及了化学反应中根据化学方程式的有关计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaCl和NaNO3 | B. | CaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | NaOH和NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

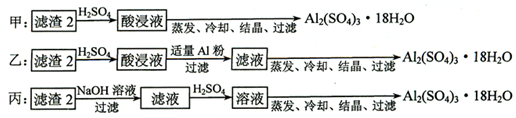
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
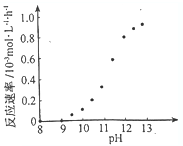 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.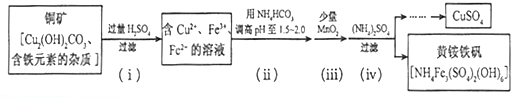
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
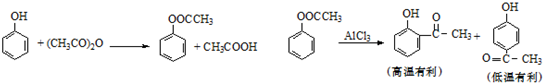
| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com