
氧硫化碳(C0S)可替代磷化氢而被用作熏蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是 (填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是 (填字母)。
A.最高正化合价:P>C
B.同温同浓度的两溶液的酸性H3P04>H2 C03
C.沸点:PH3CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去)

①已知:常温下,反应中每吸收1.7gH2S气体,反应放出热量4.76 kj,则该反应的热化学方程式为 。
②已知M溶液中硫元素的主要存在形式为S2032-,则反应中生成S2032-的离子方程式为 。
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是
A.R和N元素的原子含有相同数目的未成对电子
B.RO3-中R的化合价与NO3-中的N的化合价不相等
C.RO3-和NO3-只能被还原,不能被氧化
D.R原子的电子层数比N的电子层数多1
查看答案和解析>>
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。


(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
pH | 11 | 11 | 11 | 10 | |||
反应时间 | 3 | 3 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第三次月考化学试卷(解析版) 题型:选择题
HF气体分子间容易缔合.某HF气体由HF、(HF)2、(HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为( )
A.51% B.56% C.57% D.10%
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:实验题
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:

已知:l.0mol·L﹣1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 , 分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应; 猜想2:在酸性条件下SO2与NO3﹣反应; 猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】:猜想1成立.其结论正确吗? (填“是”或“否”)。若不正确,理由是
(用离子方程式表示)。
(5)乙同学设计实验验证猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填序号)。
a.0.1mol/L稀硝酸 b.1.5mol/LFe(NO3)2溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合的溶液
d.3.0mol/LNaNO3和0.1mol/L硫酸等体积混合的溶液
(6)(4分)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程: 、 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A、含金属元素的离子一定是阳离子
B、在氧化还原反应中,非金属单质一定是还原剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为l:l:6。下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为l
D.向该溶液中加入过量铁粉,只发生置换反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上学期12月月考理综化学试卷(解析版) 题型:选择题
下列各组离子能在指定溶液中共存的是( )
①无色溶液中: 、
、 、
、 、
、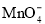 、
、
②使pH试纸变深蓝的溶液中: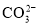 、
、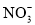 、
、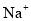 、
、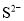 、
、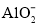 、
、
③水电离的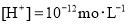 的溶液中:
的溶液中: 、
、 、
、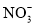 、
、 、
、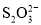
④既能溶解Al(OH)3,又能溶解H2SiO3的溶液中: 、
、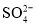 、
、 、
、
⑤使甲基橙变红的溶液中: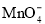 、
、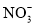 、
、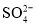 、
、 、
、
⑥pH=0的溶液中: 、
、 、
、 、
、 、
、 、
、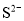
A.①③ B.②④⑤ C.①②⑤ D.③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com