
| A. | C4H8、C2H4 | B. | CH4、C2H5OH | C. | C2H6、C3H8 | D. | CH3COOH、C3H8 |
分析 同系物判断规律:①一差:分子组成相差若干个某种原子团,即相对分子质量差保持一致,犹如等差数列中的公差. ②一同:同通式.③一似:结构相似.
同系物的特点:1.同系物一定符合同一通式;
但符合同一通式的不一定是同系物;
2.同系物必为同一类物质;
3.同系物化学式一定不相同;
4.同系物的组成元素相同;
5.同系物结构相似,不一定完全相同;
6.同系物之间相差若干个CH2原子团.
解答 解:A.C4H8可能是烯烃也可能是环烷烃,与乙烯可能是同系物,也可能不是同系物,故A错误;
B.CH4和C2H5OH不是同一类物质,一定不是同系物,故B错误;
C.C2H6、C3H8都是烷烃,碳原子数不同,一定是同系物,故C正确;
D.CH3COOH、C3H8不是同一类物质,一定不是同系物,故D错误;
故选C.
点评 本题考查同系物的辨析,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题,掌握同系物的判断规律和特点是解题的关键.


科目:高中化学 来源: 题型:选择题
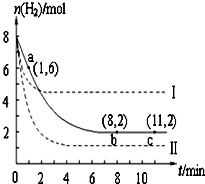 T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | T℃时,该反应的化学平衡常数为0.125 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应?△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的溶液一定比弱电解质的溶液导电性强 | |
| B. | 易溶性强电解质的溶液中不存在溶质分子 | |
| C. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| D. | 由于硫酸钡难溶于水,所以是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| B. | 根据Ksp(CaCO3)<Ksp(CaSO4),在生产中可用Na2CO3溶液处理锅炉水垢中的CaSO4,使之转化为疏松、易溶于酸的CaCO3 | |
| C. | 常温下,将醋酸稀溶液加水稀释,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 已知反应:3H2(g)+WO3(s)=W(s)+3H2O(g)只有在高温时才能自发进行,则它的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 2NO(g)+2CO(g)=N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H<0 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
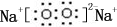 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 由苯制溴苯;CH4制CH2Cl2 | |
| D. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com