
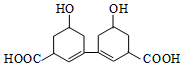
 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
科目:高中化学 来源: 题型:解答题
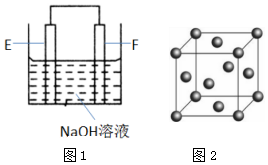 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
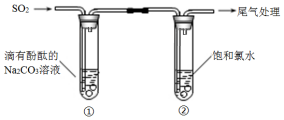
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |
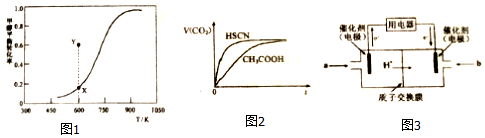
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
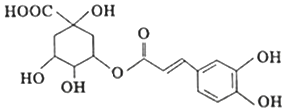
| A. | 绿原酸分子中有4种含氧官能团 | |
| B. | 绿原酸能发生取代、加成、消去和氧化反应 | |
| C. | 绿原酸在酸性条件下的水解产物均能与FeCl3发生显色反应 | |
| D. | l mol绿原酸与足量钠反应,可生成4 molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com