
| ��Է������� | �е㣨�棩 | |
| �Ҵ� | 46 | 78.5 |
| ���� | 60 | 117.9 |
| �������� | 88 | 77.1 |
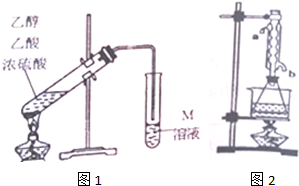
���� ��1�����Ƭ�Ĵ��ڿ��Է�ֹ�ڼ��ȹ����в����������������Ƭʱ��Ҫ���Ѽ��ȵ���Һ��ȴ���ټ��룻
��2���Թ���M��Һ������������������ͨ��ʹ��̼������Һ�������Ҵ�������������̼������Һ�����Ե��ܲ�����Һ��������������
��3�����Թܸij�Բ����ƿ��Ȼ���װ�¶ȼƿ����¶ȣ�������������IJ��ʣ�
��4��������������������ͨˮЧ������ɣ���������ʵ��١��ڲ��������ݼ���Ӧԭ��������ֲ�������������������������
��� �⣺��1��ȱ�����Ƭ�ᷢ�����������������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ô���Һ��ȴ���ټ��룬����C��ȷ��
�ʴ�Ϊ��C��
��2������������̼������Һ�е��ܽ�Ƚ�С����̼������Һ�ܹ��������ᡢ�ܽ��Ҵ�������MΪNa2CO3������������Ҵ���������Na2CO3��Һ�����Թ�����������������
�ʴ�Ϊ��Na2CO3��������Ҵ���������Na2CO3��Һ��
��3����������������ȡ�����У��Ҵ��������ܹ��ӷ�������Ӱ�������������IJ��ʣ����Լ�װˮ�����ܣ������ȴЧ����Ҳ������Բ����ƿ����Թܲ���װ�¶ȼƿ��Ʒ�Ӧ�¶ȵķ�����ͨ�����������IJ��ʣ�
�ʴ�Ϊ����װˮ�����ܣ������ȴЧ������Բ����ƿ��������ƿ������װ�¶ȼƿ��Ʒ�Ӧ�¶ȣ�����������Ҳ���֣���
��4����������������ͨˮ��ʹˮ�������������ֽӴ�������Ч���ã��ʴ�bͨˮ��
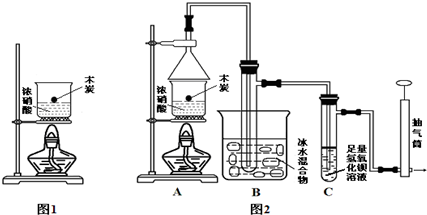
�ɢٿ�֪�����������Ʒ�Ӧ�������������е��������ᣬ����20g����������Ʒ�к�����������ʵ���Ϊ��0.50mol•L-1��0.04L=0.02mol��
���ݢڿ�֪����������ˮ�����ɵ�����������������ĵ��������Ƶ����ʵ���Ϊ��2.1mol•L-1��0.1L-0.50mol•L-1��0.02L=0.20mol��
��������ˮ�����ɵ���������ʵ���Ϊ��0.20mol-0.02mol=0.18mol��
�������������ʵ���������������ʵ���������20g����������Ʒ�к�����������������Ϊ��88g/mol��0.18g=15.84g��
��������������������$\frac{15.84g}{20g}$��100%=79.2%��
�ʴ�Ϊ��b��79.2%��
���� ���⿼����������������ȡ����Ŀ�Ѷ��еȣ�ע���������������ķ�Ӧԭ����װ��ѡ��������ע�ض�ѧ������֪ʶѵ���ͼ����ͬʱ�����ض�ѧ��ʵ����������������ͷ����뼼�ɵ�ָ����ѵ�������������ѧ����ʵ�����������Ӧ������������ѧ����ѧ��������


 �¾�����ĩ���100��ϵ�д�
�¾�����ĩ���100��ϵ�д� ȫ�ܴ���100��ϵ�д�
ȫ�ܴ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2+4HF=SiF4��+2H2O���������ʴ�̲��� | |
| B�� | 4Na+TiCl4 $\frac{\underline{\;����\;}}{\;}$4NaCl+Ti���ý�����������TiCl4��Ӧ��ȡ����Ti | |
| C�� | CO32-+H2O?H2CO3+OH-�����ȵĴ�����Һ��ϴ�;����� | |
| D�� | MgCl2$\frac{\underline{\;���\;}}{\;}$Mg+Cl2������ҵ���õ�������Ȼ�þ��ȡ����þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 84 g NaHCO3�������NA��CO32- | |
| B�� | �����£�14.0 g��ϩ�Ͷ�ϩ�Ļ�������к���C-H����ĿΪ2.0NA | |
| C�� | ��⾫��ͭʱ����������������6.4 g�����·��ת�Ƶ�����Ϊ0.2NA | |
| D�� | 78 g Na2O2��������CO2��Ӧ������ת�Ƹ���Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �ݻ� | �ݻ�/L | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| C��s�� | H2O | H2 | ||||
| �� | 2 | T1 | 2 | 4 | 3.2 | 8 |
| �� | 1 | T2 | 1 | 2 | 1.2 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4+2NaOH�TNa2SO4+2H2O | B�� | CuO+H2 $\frac{\underline{\;\;��\;\;}}{\;}$ Cu+H2O | ||
| C�� | NH3+HCl�TNH4Cl | D�� | 2NaHCO3 $\frac{\underline{\;\;��\;\;}}{\;}$ Na2CO3+H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧʽ | ���볣�� |
| CH3COOH | K=1.7��10-5 |
| HCN | K=4.9��10-10 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
| A�� | H2CO3��HCO3-��CH3COO-��CN- | B�� | HCO3-��CH3COOH��CN-��CO32- | ||
| C�� | HCN��HCO3-��CN-��CO32- | D�� | HCN��HCO3-��CH3COO-��CN- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
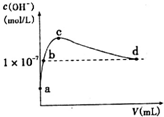 �����£���l L pH=l0��NaOH��Һ�г���ͨ��CO2��ͨ��CO2�������y������Һ��ˮ�������c��OH-���Ĺ�ϵ��ͼ��ʾ����������������ǣ�������
�����£���l L pH=l0��NaOH��Һ�г���ͨ��CO2��ͨ��CO2�������y������Һ��ˮ�������c��OH-���Ĺ�ϵ��ͼ��ʾ����������������ǣ�������| A�� | a����Һ�У�ˮ�������c��H+��=1��10-10mol•L-1 | |
| B�� | b����Һ�У�c��H+��=1��10-7mol•L-1 | |
| C�� | c����Һ�У�c��Na+����c��HCO3-����c��CO32-�� | |
| D�� | d����Һ�У�c��Na+��=2c��CO32-��+c��HCO3-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com