
【题目】下列关于“焰色反应”的理解和应用不正确的是
A.可用光洁无锈的铁丝替代铂丝作焰色反应实验
B.实验完成后铂丝用盐酸洗净,在外焰上灼烧至没有颜色时再使用
C.只有某些金属或其化合物才有焰色反应
D.用焰色反应鉴别NaCl、KCl和K2SO4
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是( )
A. 向氢氧化钾溶液中滴加少量氯化铝溶液Al3++4OH-=AlO2-+2 H2O
B. 向(NH4)2SO4溶液中加入足量Ba(OH)2:Ba2++SO42-=BaSO4↓
C. 碳酸氢钠溶液中加入过量氢氧化钠溶液 HCO3- + OH- =CO32- + H2O
D. 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水解:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3- = 9Fe3++NO↑+14H2O
C. 少量的SO2通入NaClO溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+
D. 向含Ba(OH)2和KOH均为0.1mol的混合溶液中通入标准状况下4.48LCO2气体:Ba2++3OH-+2CO2=BaCO3↓+HCO3-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.玛瑙的主要成分是硅酸盐
B.某浓度的HNO3在反应中不可能被还原成NH3
C.普通水泥是硅酸盐材料
D.二氧化硅是将太阳能转换为电能的常用材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 18克的D216O中含有的中子数为9NA
B. 标准状况下,22.4LSO3含有的原子数为4NA
C. 80ml10mol/L盐酸与足量MnO2加热反应,产生的Cl2分子数为0.2NA
D. 精炼铜过程中,阳极质量减少6.4g时,电路中转移电子为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
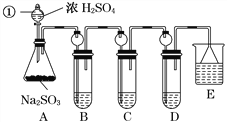
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com