
����Ŀ��ԭ���������������A��B��C��D��E��F����Ԫ�ء�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ29��
��1��F��̬ԭ�ӵĺ�������Ų�ʽΪ______________________��
��2����A��B��C����Ԫ���У���һ��������С�����˳����___________����Ԫ�ط��Żش𣩡�
��3��Ԫ��B�ļ���̬�⻯��ķе�___________������������������������Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ����______________________��
��4����A��B��C�γɵ�����CAB��AC2��Ϊ�ȵ����壬��CAB�ĽṹʽΪ___________��
��5����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ___________��

��6��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ��______________________��
���𰸡� 1s22s22p63s23p63d104s1��3d104s1 C<O<N ���� NH3����֮������������CH4���Ӽ�������Ƿ��»���������ȷ��»�����ǿ [N=C=O] NaNO2 Cu+��Χ����3d10���ȫ�����ȶ���Cu2+��Χ����3d9������ӷ�ȫ����״̬���ȶ�
��������ԭ���������������A��B��C��D��E��F����Ԫ�أ�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p2����AΪ̼Ԫ�أ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ����Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4����CΪOԪ�أ���ԭ��������֪BΪNԪ�أ�F��ԭ������Ϊ29����FΪCu��E��Cλ��ͬһ���壬��EΪSԪ�أ�DΪ������������ԭ�Ӱ뾶��������Ԫ�أ����ڢ�A�壬ԭ����������OԪ��С��SԪ�أ���DΪNa����1��Fԭ�Ӻ��������Ϊ29����̬�ĺ�������Ų�ʽΪ[Ar]3d104s1����2��ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ���NԪ��2p�ܼ�����3�����ӣ����ڰ����ȶ�״̬�������ϵͣ���һ�����ܸ�����Ԫ�أ��ʵ�һ������N��O��C����3��NH3����֮����������CH4���Ӽ�������Ƿ��»���������ȷ��»�����ǿ������е����CH4����4��OCN-��CO2��Ϊ�ȵ����壬�۵���������ȣ����߽ṹ���ƣ���OCN-�ĽṹʽΪ[N=C=O]-����5���ɾ����ṹ��֪�������д���NO2-�ṹ����λ�ڶ�������ģ�����Ŀ=1+8��![]() =2��Na+λ��8��������ģ���Ŀ=8��
=2��Na+λ��8��������ģ���Ŀ=8��![]() =2���ʸû�����Ļ�ѧʽΪNaNO2����6��Cu+��Χ����3d10���ȫ�����ȶ���Cu2+��Χ����3d9������ӷ�ȫ����״̬���ȶ�����CuO�ڼ�������������ת��ΪCu2O��
=2���ʸû�����Ļ�ѧʽΪNaNO2����6��Cu+��Χ����3d10���ȫ�����ȶ���Cu2+��Χ����3d9������ӷ�ȫ����״̬���ȶ�����CuO�ڼ�������������ת��ΪCu2O��


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�з�������ͼ����ǣ������� 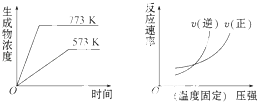
A.N2��g��+3H2��g��2NH5��g����H=��Q1kJmol��1��Q1��0��
B.2SO5��g��2SO2��g��+O2��g����H=+Q2kJmol��1��Q2��0��
C.4NH5��g��+5O2��g��4NO��g��+6H2O��g����H=��Q3kJmol��1��Q3��0��
D.H2��g��+CO��g��C��g��+H2O��g����H=+Q4kJmol��1��Q4��0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϩ(CH3COOCH=CH2)��һ����Ҫ���л�����ԭ�ϣ��Զ�����(CH3OCH3)��ϳ���(CO��H2)Ϊԭ��,����ﮡ�������Ϊ�������ڸ�ѹ��Ӧ����һ���ϳɴ�����ϩ�����ᡣ
�ش���������:
��1��������,��Ũ�Ⱦ�Ϊa mol/L�Ĵ������Һ�ʹ�����Һ�������ϣ���û��Һ��pH=b������Һ��c(CH3COO-)=______mol/L( �г�����ʽ����)��
��2���ϳɶ�����:
��.2H2(g)+CO(g)=CH3OH(g) ��H1=-91.8kJ/mol;
��.2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H2=-23.5 kJ/mol;
��.CO(g)+H2O(g)=CO2(g)+H2(g) ��H3=-41.3 kJ/mol.
��֪:H-H �ļ���Ϊ436kJ/mol��C=O�ļ���Ϊ803kJ/mol��H-O�ļ���Ϊ464kJ/mol����C��O�ļ���Ϊ_____kJ/mol.
��3��������(DME)��ϳ���һ�����ϳɴ�����ϩ(VAC)�ķ�Ӧ����ʽΪ2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g)��T��ʱ,��2L�����ܱշ�Ӧ���м���0.2 molCH3OCH3��0.4 molCO��0.1molH2����������Ӧ,10min�ﵽ��ѧƽ�⣬���VAC�����ʵ�������Ϊ10%��
CH3COOCH=CH2(g)+2CH3COOH(g)��T��ʱ,��2L�����ܱշ�Ӧ���м���0.2 molCH3OCH3��0.4 molCO��0.1molH2����������Ӧ,10min�ﵽ��ѧƽ�⣬���VAC�����ʵ�������Ϊ10%��
��0~10min��,��COŨ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)=______;���¶���,�÷�Ӧ��ƽ�ⳣ��K=__________��
��������˵���÷�Ӧ�ﵽƽ��״̬����______(��ѡ����ĸ)��
A.V��(DME)=v��(H2)��0
B.���������ܶȲ��ٱ仯
C.��������ƽ����Է����������ٱ仯
D.c(CO):c(VAC)=4:1
����ͼ�Ƿ�Ӧ�¶ȶԶ�����(DME)��ת���ʺʹ�����ϩ(VAC)ѡ����(������ϩ��ѡ����Svac=![]() )��Ӱ�죬�÷�Ӧ����H______0(����>����<������=��);���Ƶ�����¶���___________.
)��Ӱ�죬�÷�Ӧ����H______0(����>����<������=��);���Ƶ�����¶���___________.

�ܱ����¶Ȳ���,��Ӧ����ͨ���������ѹǿ,��ѧƽ��______(����������Ӧ�����������淴Ӧ����"��������)�ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2008�걱�����˻�ġ����ơ��������ȼ�ϵ���Ҫ�ɷ��DZ��飬�����йر����������ȷ���ǣ� ��
A. ����Ȼ������Ҫ�ɷ� B. �������ܹ�����ȡ����Ӧ
C. �붡�黥Ϊͬ���칹�� D. ������̼ԭ����һ��ֱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q��ԭ���������������5�ֶ���������Ԫ�ء���ͼת����ϵ�����漰�����ʺ���������Ԫ�صĵ��ʻ�����з�Ӧ�����û���Ӧ,AΪ��������,DΪ�ǽ�������,ԭ�Ӻ�������������D��A��2��,F��һ����ۺ�����,������Ȼ�ֽ⡣����˵����ȷ����
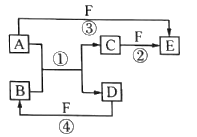
A. ���⻯��ķе�:Z>W
B. Y��W�γɵĻ����ﶼ���Ժ�����������Һ��Ӧ
C. Y��Z��WԪ����,ԭ�Ӱ뾶��С����W
D. W��Q��ɵij����������п��ܺ��м��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�����仯�����Ƿdz���Ҫ�����ʡ�
��1��Cu���ĵ����Ų�ʽ____��
��2��������ͭ��Һ�м������KCN�����������[Cu(CN)4]2����[Cu(CN)4]2��������Ϊ____��[Cu(CN)4]2����C���ӻ���ʽΪ____����1��[Cu(CN)4]2���к��еĦҼ�����ĿΪ____����
��3��ﮡ�������ͭ��������Ļ���������Cu4O(PO4)2��������ˮ����ͨ��Na3PO4��CuSO4��NH3��H2O��Ӧ��ȡ����ȡCu4O(PO4)2�Ļ�ѧ����ʽΪ____��
��4��PCl5��P-Cl������198pm��206pm���֡�PCl5�ǷǼ��Է��ӣ�����Ϊ�������壬��ԭ��ΪPCl5����Ϊһ�������Ӻ�һ�������ӣ�����������Ϊ�������壬������Ϊ�������壬д��һ�������ӵĵȵ�����Ļ�ѧʽ____��PCl5�����幹��Ϊ____��
��5������ͭ���������������壬ͭ���ܶ�Ϊag��cm3��NA��ʾ����٤����������ͭ����λ��____��ͭ�Ľ����뾶Ϊ___pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ý��е�⣮ͨ��һ�����������NaCl��Һʪ��ĵ���KI��ֽ��C�˱�Ϊ��ɫ�� 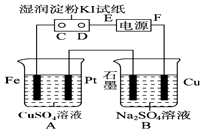
��1��EΪ��Դ������FeΪ����
��2��A�з�����Ӧ�����ӷ���ʽΪ �� B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����B�й۲쵽��������
��4�����˵�ԴΪǦ���أ�����ܷ�ӦʽΪ�� Pb+PbO2+4H++2SO42�� ![]() PbSO4+2H2O
PbSO4+2H2O
��ŵ�ʱ�������ĵ缫��Ӧʽ�������ʱ�������ĵ缫��Ӧʽ���������·ͨ��1mol����ʱ�������ϸ��������������g����ʱ��ҪʹA���е���Һ��ԭ��Ӧ����g��CuO���壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.Mg��Ħ��������24g/mol
B.22gCO2���ʵ���Ϊ2.2mol
C.1molCl2�к��е���ԭ����ԼΪ6.02��1023
D.���³�ѹ�£�1molN2�������22.4L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com