
分析 根据化合价升降总数相等进行解题.
(1)C:0→+4,↑4,×1
N:+5→+4,↓1,×4
(2)S:0→+6,↑6,×1
N:+5→+4,↓1,×6
(3)Ag:0→+1,↑1,×3
N:+5→+2,↓3,×1
再根据质量守恒定律得出正确结论.
解答 解:(1)C:0→+4,↑4,×1
N:+5→+4,↓1,×4
据得失电子守恒C的化学计量数为1,硝酸的化学计量数为4,据原子守恒,二氧化氮的化学计量数为4,水的化学计量数为2,
故答案为:1;4;1;4;2;
(2)S:0→+6,↑6,×1
N:+5→+4,↓1,×6
据得失电子守恒S的化学计量数为1,硝酸的化学计量数为6,据原子守恒硫酸的化学计量数为1,二氧化氮的化学计量数为6,据H原子守恒,水的化学计量数为2,
故答案为:1;6;1;6;2;
(3)Ag:0→+1,↑1,×3
N:+5→+2,↓3,×1
据得失电子守恒硝酸的化学计量数为1,Ag的化学计量数为3,据原子守恒硝酸银的化学计量数为3,硝酸在该反应中表现了酸性和氧化性,表现酸性的硝酸生成了硝酸银,3molAg反应有3mol硝酸表现了酸性,据原子守恒可知,硝酸的化学计量数应为4,据H原子守恒,水的化学计量数为2,
故答案为:3;4;3;1;2.
点评 氧化还原反应配平是高考不变的一个题型,每年高考中必考,是热点题型.本题考查了运用化合价升降法以及质量守恒定律进行配平.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
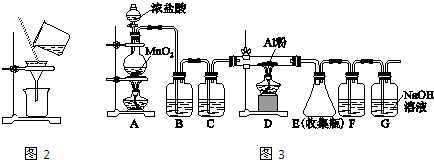
 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
 .
. ,F
,F .
. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
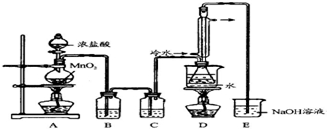
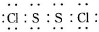 ,它不稳定,在水中易发生岐
,它不稳定,在水中易发生岐| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①用铜和浓硝酸制取少量NO2 | B. | ②比较S、C、Si的非金属性 | ||
| C. | ③验证HCl溶解性 | D. | ④用于吸收NH3尾气,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3具有还原性 | B. | H-是很强的还原剂 | ||
| C. | H2是氧化产物,NH2$_2^-$是还原产物 | D. | 该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的平均相对分子质量不变 | D. | 的转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com