
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4— (绿色)、Cr2O72—(橙红色)、CrO42— (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______,离子方程式____________________________。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol·L1的Na2CrO4溶液中c(Cr2O![]() )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
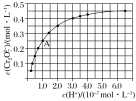
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________。
②由图可知,溶液酸性增大,CrO42—的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42—的平衡转化率减小,则该反应的ΔH_____0(填“大于”“小于”或“等于”)。(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42—生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×105molL1)时,溶液中c(Ag+)___molL1,此时溶液中c(CrO42—)等于_____molL1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】溶液蓝紫色褪去,转化为灰蓝色固体,后逐渐溶解,溶液成为绿色溶液 Cr3++3OH—===Cr(OH)3↓ Cr(OH)3+ OH—=Cr(OH)42—溶液由黄色变为橙红色增大1.0×1014(mol·L1)2小于2.0×1055.0×103
【解析】
(1)依据Cr3+与Al3+的化学性质相似,由Al3+和NaOH溶液的反应情况,不难推得,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量的现象是:
原来Cr3+的蓝紫色的溶液,逐渐变成灰蓝色的Cr(OH)3沉淀,离子方程式为:Cr3++3OH-= Cr(OH)3![]() ,而后又逐渐溶解变为Cr(OH)4-的绿色溶液,离子方程式为:Cr(OH)3+ OH-= Cr(OH)4-;
,而后又逐渐溶解变为Cr(OH)4-的绿色溶液,离子方程式为:Cr(OH)3+ OH-= Cr(OH)4-;
(2)①从方程式及图示看出,随着酸性的增强,Cr2O72-的浓度逐渐升高,所以溶液由黄色变为橙红色;
②从方程式及图示看出:该转化随着溶液酸性增大,CrO42的平衡转化率将增大。从题给图示中,该反应的A点时c(H+)=10-7mol·L1,c(Cr2O72)=0.25 mol·L1,由Cr元素守恒,c(CrO42-)=1-2×0.25=0.5 mol·L1,故该转化的平衡常数K=0.25/(0.52×10-7×10-7)=1014;
③若温度升高,溶液中CrO42的平衡转化率减小,则该反应平衡逆向移动,该转化为放热反应,其ΔH小于0。
(3)由沉淀的溶度积计算c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×1010/1.0×105=2.0×10–5。在该溶液中c(CrO42-)= Ksp(Ag2CrO4)/c2(Ag+)=2.0×1012/(2.0×105)2=5×10-3mol·L1。


科目:高中化学 来源: 题型:
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
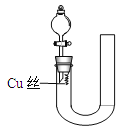
A. 应先打开活塞再从右侧加稀硝酸
B. 左侧稀硝酸须注满
C. 关闭活塞后铜丝会全部溶解
D. 反应停止后打开活塞气体变成红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1mol·L1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
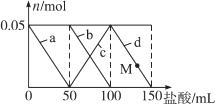
A. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用0.1 mol/L 的盐酸滴定20.00 mL NaOH溶液,测定其浓度。下列操作正确的是
A. 需用NaOH溶液润洗锥形瓶
B. 用量筒量取20.00 mL NaOH溶液
C. 滴定前,使酸式滴定管尖嘴部分充满盐酸
D. 充分反应后,滴入酚酞溶液,观察是否到达滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质①过氧化钠、②氧化铝、③硅、④二氧化硅。
请根据它们的用途填空:(填序号)
(1)可用来制计算机芯片的是_________。
(2)可用于呼吸面具中作为氧气来源的是_________。
(3)能作光导纤维的是_________。
(4)能作耐火材料的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
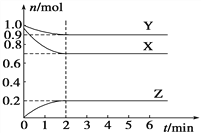
(1)该反应的化学方程式为_______________;
(2)反应开始至2 min,气体Z的反应速率为_________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为______反应(填“放热”或“吸热”)。
(4)若X为固体、Y、Z为气体,则该反应的平衡常数表达式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com