
【题目】硫及其化合物在工业上有着广泛的应用.
完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式 .
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
Mn2++S2O82﹣+H2O→ MnO4﹣+SO42﹣+H+
配平该反应方程式,氧化产物是 .
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在(填:“阳极”或“阴极”)反应生成S2O82﹣ , 另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气.
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);
H++SO42﹣(Ki=1.2×10﹣2);
在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 , 第4位的离子是 . 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 ![]() (填:“增大”、“减小”或“不变”)
(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣,K=1.02×10﹣7
NH4++H2ONH3H2O+H+ , K=5.65×10﹣10
往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是(选填编号).
a.HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ .
【答案】
(1)S+O2 ![]() SO2
SO2
(2)2;5;8;2;10;16;MnO4﹣
(3)阳极;0.2
(4)HSO4﹣;SO42﹣;减小
(5)cd
【解析】解:(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸,第一步反应的化学方程式为:S+O2 ![]() SO2 , 故答案为:S+O2
SO2 , 故答案为:S+O2 ![]() SO2;(2)反应中锰元素化合价+2价变化为+7价,电子转移5e﹣ , S2O82﹣中硫元素化合价+7价变化为SO42﹣中 硫元素化合价+6价,电子转移2e﹣ , 电子转移总数为10e﹣ , Mn2+前系数,2,S2O82﹣ , 前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82﹣+8H2O=2MnO4﹣+10SO42﹣+16H+ , 反应中锰元素化合价+2价变化为+7价,做还原剂被氧化生成氧化产物为MnO4﹣ , 故答案为:2,5,8,2,10,16,MnO4﹣;(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82﹣ , HSO4﹣在阳极反应生成S2O82﹣ , 电极反应为:2HSO4﹣﹣2e﹣═S2O82﹣+2H+ , 另一极生成氢气,电极反应为2H++2e﹣=H2↑,阳极电子守恒计算,生成0.1mol的S2O82﹣同时,电子转移0.2mol,S2O82﹣~H2↑~2e﹣ , 可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g,故答案为:阳极,0.2;(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4﹣)>c(H+)>c(SO42﹣)>c(OH﹣),则该溶液中离子浓度由大到小排列第2位的离子是HSO4﹣ , 第4位的离子是SO42﹣ , 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4﹣)、c(K+)浓度增大,但对于电离平衡,HSO4﹣H++SO42﹣ , 硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4﹣)增大的多,
SO2;(2)反应中锰元素化合价+2价变化为+7价,电子转移5e﹣ , S2O82﹣中硫元素化合价+7价变化为SO42﹣中 硫元素化合价+6价,电子转移2e﹣ , 电子转移总数为10e﹣ , Mn2+前系数,2,S2O82﹣ , 前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82﹣+8H2O=2MnO4﹣+10SO42﹣+16H+ , 反应中锰元素化合价+2价变化为+7价,做还原剂被氧化生成氧化产物为MnO4﹣ , 故答案为:2,5,8,2,10,16,MnO4﹣;(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82﹣ , HSO4﹣在阳极反应生成S2O82﹣ , 电极反应为:2HSO4﹣﹣2e﹣═S2O82﹣+2H+ , 另一极生成氢气,电极反应为2H++2e﹣=H2↑,阳极电子守恒计算,生成0.1mol的S2O82﹣同时,电子转移0.2mol,S2O82﹣~H2↑~2e﹣ , 可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g,故答案为:阳极,0.2;(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4﹣)>c(H+)>c(SO42﹣)>c(OH﹣),则该溶液中离子浓度由大到小排列第2位的离子是HSO4﹣ , 第4位的离子是SO42﹣ , 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4﹣)、c(K+)浓度增大,但对于电离平衡,HSO4﹣H++SO42﹣ , 硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4﹣)增大的多, ![]() 比值减小,故答案为:HSO4﹣ , SO42﹣ , 减小;(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7 , NH4++H2ONH3H2O+H+ K=5.65×10﹣10 , 亚硫酸氢根离子电离程度大于一水合氨的电离程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,a.从选项中的离子方程式分析,HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3﹣+Ba2++2OH﹣→BaSO3↓+2H2O+SO32﹣ , 故a错误;b.选项中离子方程式分析,NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O,电离出2molBa2+ , 电离出的氢氧根离子为4mol,其中2molOH﹣和2mol亚硫酸氢根离子反应,2molOH﹣和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O,故B错误;
比值减小,故答案为:HSO4﹣ , SO42﹣ , 减小;(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7 , NH4++H2ONH3H2O+H+ K=5.65×10﹣10 , 亚硫酸氢根离子电离程度大于一水合氨的电离程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,a.从选项中的离子方程式分析,HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3﹣+Ba2++2OH﹣→BaSO3↓+2H2O+SO32﹣ , 故a错误;b.选项中离子方程式分析,NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O,电离出2molBa2+ , 电离出的氢氧根离子为4mol,其中2molOH﹣和2mol亚硫酸氢根离子反应,2molOH﹣和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O,故B错误;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应的离子方程式,NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O,故c正确;d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ , 分析离子方程式,反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH﹣离子先和4molHSO3﹣反应,剩余 2molOH﹣离子再和2molNH4+离子反应剩余2molNH4+离子生成亚硫酸铵,反应的离子方程式正确,故d正确,故答案为:cd.
(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸;(2)反应中锰元素化合价+2价变化为+7价,电子转移5e﹣ , S2O82﹣中硫元素化合价+7价变化为SO42﹣中 硫元素化合价+6价,电子转移2e﹣ , 结合电子守恒和原子守恒配平书写得到反应的离子方程式,元素化合价升高的做还原剂被氧化,得到氧化产物;(3)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82﹣ , HSO4﹣离子在阳极失电子生成S2O82﹣ , 电极反应为:2HSO4﹣﹣2e﹣═S2O82﹣+2+ , 结合电极反应电子守恒计算得到生成氢气的质量;(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4﹣)>c(H+)>c(SO42﹣)>c(OH﹣),往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4﹣)、c(K+)浓度增大,但对于电离平衡,HSO4﹣H++SO42﹣ , 硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4﹣)增大的多;(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7 , NH4++H2ONH3H2O+H+ K=5.65×10﹣10 , 亚硫酸氢根离子电离程度大于一水合氨的电离程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合氢氧化钡化学式的组成比,;b.选项中离子方程式分析,NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O,电离出2molBa2+ , 电离出的氢氧根离子为4mol,其中2molOH﹣和2mol亚硫酸氢根离子反应,2molOH﹣和2molNH4+离子反应,是氢氧化钡和亚硫酸氢铵1:1恰好完全反应;c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应;d.反应是4molNH4HSO3和3molBa(OH)2的反应,6molOH﹣离子先和4molHSO3﹣反应,剩余 2molOH﹣离子再和2molNH4+离子反应剩余2molNH4+离子生成亚硫酸铵;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于1mol/L K2SO4溶液的下列说法正确的是( )
A. 溶液中含有1mol/L K2SO4
B. 1mol/L K2SO4溶于1L水中
C. 溶液中c(K+)=2mol/L
D. 溶液中含2mol K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,硫酸钡与水组成的混合物中,存在下列过程:BaSO4(s)Ba2++SO ![]() ,向其中加入少量硫酸钠固体,下列说法错误的是( )
,向其中加入少量硫酸钠固体,下列说法错误的是( )
A.BaSO4的电离程度减小
B.BaSO4溶解的量减小
C.c(Ba2+)与c(SO42﹣)的乘积增大
D.溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列现象的化学用语正确的是( )
A.铁钉在空气中出现红色的铁锈,其负极反应式为:Fe﹣3e﹣═Fe3+
B.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH ![]() ═Mg2++NH3?H2O
═Mg2++NH3?H2O
C.向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO ![]() +AlO
+AlO ![]() +H2O═Al(OH)3↓+CO
+H2O═Al(OH)3↓+CO ![]()
D.漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO﹣+2H2O═Fe(OH)2↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用同一原理解释的是
A.Cl2与Fe、Cu反应均生成高价氯化物 B.NH4HCO3晶体、固体I2受热均能变成气体
C.SO2、Cl2均能使品红溶液褪色 D.ClO与 Fe2+、H+均不能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如下图所示,下列说法正确的是
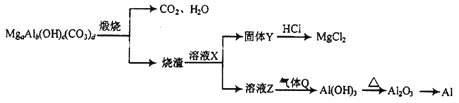
A. Q可能为NH3
B. X可能为NaOH
C. a、b、c、d符合关系式:2a+3b=c+2d
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为_____,干燥管D的作用为__________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有______溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于S、SO2、H2SO4的叙述中,正确的是
A.硫是一种易溶于水的黄色晶体 B.SO2溶于水生成H2SO4
C.用氢氧化钠溶液处理含有SO2的尾气 D.浓H2SO4不稳定,光照易分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com