

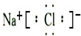 ,故A错误;
,故A错误;

科目:高中化学 来源:山东省月考题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
四川自贡盛产食盐,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。
(1)在以食盐为原料进行的化工生产中,往往首先需要对粗盐进行提纯。为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(每个步骤用于沉淀的试剂稍过量):
粗盐溶解![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
①蒸发时所用的实验仪器有铁架台、酒精灯、 ,蒸发操作即将结束,当 时,熄灭酒精灯。
②在加入适量盐酸的步骤中,相关的离子方程式是 。
③若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
(2)食盐可用于工业上制纯碱。涉及到的化学反应方程式有:NH3+CO2+H2O=NH4HCO3,
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
请回答:
方法是向饱和食盐水先通入 ,再通入 ,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱。工业制得的纯碱中常常含有少量的氯化钠杂质,检验氯化钠杂质的实验方法是 。
(3)食盐也是工业上生产氯气和烧碱的重要原料。下图是工业上电解饱和食盐水的离子交换膜电解槽示意图。
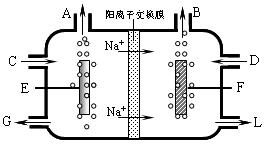
①B处出口产生的物质是 ;C处进口的物质是 。
②该电解槽的阳极反应式是 。
③通电开始后,阴极附近溶液pH会增大,请简述原因
④采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠,同时生成氢气,现制得次氯酸钠149.0kg,则生成氢气 m3(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com