

分析 (1)热化学方程式中,反应热=反应物的总键能-生成物的总键能,据此计算反应焓变;
(2)①依据题干条件和三行计算得到,气体压强之比等于化学方程式气体计量数之比,计算得到消耗氨气物质的量,反应速率v=$\frac{△c}{△t}$计算得到;
②B 保持温度和压强不变,随反应进行气体压强减小,体积缩小所以反应过程中B中压强始终比A中压强大,达到平衡所需时间短,平衡正向移动,NH3转化率大,氨气含量少于A;
(3)利用如图2实验装置可以合成氨,反应总方程式为N2+3H2?2NH3,反应中N元素化合价降低,被还原,应为电解池阴极反应,电极方程式为N2+6e-+6H+═2NH3,H元素化合价升高,被氧化,应为电解池阳极反应,电极方程式为H2-2e-=2H+,以此解答该题;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(F-)=0.005mol/L,以此计算;
(5)根据一水合氨电离方式书写N2H4•2H2O电离方程式.
解答 解:(1)1molH一H键、lmo1N一H键、1molN≡N键断裂时分别需要吸收436kJ、39IkJ、946kJ的能量,则氨分解反应2NH3(g)?N2(g)+3H2(g)的焓变△H=6×39IkJ/mol-3×436kJ/mol-946kJ/mol=+92kJ/mol,
故答案为:+92kJ/mol;
(2)①反应2分钟后,A容器内压强变为原来的1.2倍,气体压强之比为化学方程式计量数之比,设生成氮气物质的量为x,则
2NH3(g)?N2(g)+3H2(g)
起始量(mol) 2 0 0
变化量(mol) 2x x 3x
2min末(mol/L) 2-2x x 3x
$\frac{2-2x+x+3x}{2}$=1.2
x=0.2mol
2分钟内用氨气表示的平均反应速率=$\frac{\frac{0.2×2mol}{2L}}{2min}$=0.1mol/L•min,
故答案为:0.1;
②B 保持温度和压强不变,随反应进行气体压强减小,体积缩小所以反应过程中B中压强始终比A中压强大,达到平衡所需时间短,平衡正向移动,NH3转化率大,氨气含量少于A,据此画出变化图象为: ,
,
故答案为: ;B容器体积增大,反应过程中压强较A小,反应速率慢,平衡正向移动,NH3转化率大;
;B容器体积增大,反应过程中压强较A小,反应速率慢,平衡正向移动,NH3转化率大;
(3)利用如图2实验装置可以合成氨,反应总方程式为N2+3H2?2NH3,反应中N元素化合价降低,被还原,应为电解池阴极反应,电极反应方程式为:N2+6e-+6H+═2NH3,
故答案为:N2+6H++6e-=2NH3;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(F-)=0.005mol/L,所以用含c的代数式表示HF的电离常数Ka=$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$=$\frac{1{0}^{-7}×0.005}{\frac{c}{2}-0.005}$=$\frac{1{0}^{-9}}{c-0.01}$故答案为:$\frac{1{0}^{-9}}{c-0.01}$;
(5)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱N2H4•2H2O,该二元弱碱电离,电离方程式为:N2H4•2H2O?[N2H5•H2O]++OH-,
故答案为:N2H4•2H2O?[N2H5•H2O]++OH-.
点评 本题考查了反应热的有关计算、反应热与化学键键能的关系、化学平衡的有关知识,涉及化学平衡常数的有关计算、化学平衡状态的判断、化学反应速率的计算等知识点,图象绘制和理解是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
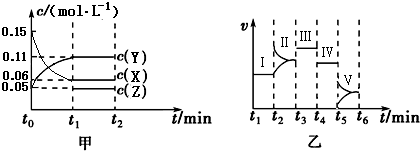
 2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.
2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
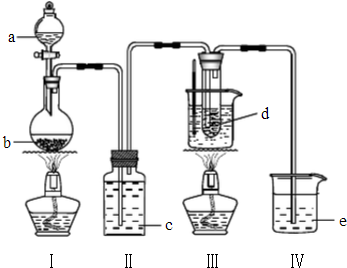 氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.
氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com