
分析 n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
①设的NO和NO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.5}\\{0.51×2=3x+y}\end{array}\right.$,
再结合V=nVm计算;
②原HNO3的物质的量为0.5mol+V×10-3L×amol/L,结合c=$\frac{n}{V}$计算.
解答 解:n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
①设的NO和NO2的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.5}\\{0.51×2=3x+y}\end{array}\right.$,
解得x=0.26mol,
V(NO)=nVm=0.26mol×22.4L/mol=5.824L≈5.8L,
故答案为:5.8L;
②待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,
则原HNO3的物质的量为0.5mol+V×10-3L×amol/L=(0.5+Va×10-3)mol,
则原HNO3的物质的量浓度为$\frac{(0.5+Va×1{0}^{-3})}{0.14}$mol/L,
故答案为:$\frac{(0.5+Va×1{0}^{-3})}{0.14}$mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握原子、电子守恒及物质的量的相关计算为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
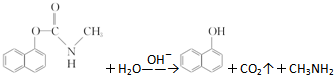
| A. | 西维因分子式为C12H10NO2 | |
| B. | 1 mol西维因最多能与6 mol氢气发生加成反应 | |
| C. | 反应后经酸化,可用FeCl3溶液检验是否发生水解 | |
| D. | 西维因分子中至少有21个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
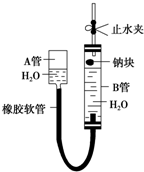 如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:
如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4中含有氯原子数目为4 NA | |
| B. | 7 g C2H4中含有的氢原子数目为NA | |
| C. | 1 mol Al 失去电子变成 Al3+后质子数目为10 NA | |
| D. | 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com