
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
B.1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA
C.2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
科目:高中化学 来源: 题型:
反应A(g)B(g)+C(g)在容积为1.0 L的密闭容器中进行,A的初始浓度为0.050 mol·L-1。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
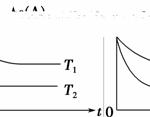
(1)上述反应的温度T1________T2,平衡常数K(T1)________K(T2)。(填“大于”、“小于”或“等于”)
(2)若温度T2时,5 min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______________________________________。
②反应的平衡常数K=________________________________________。
③反应在0~5 min区间的平均反应速率v(A)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH 2Ni(OH)2。
2Ni(OH)2。
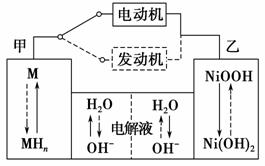
图1
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。

回答下列问题:
①A极为电源________(填“正”或“负”)极,写出A极的电极反应式:________________________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与________极(填“C”或“D”)相连。
③当消耗标准状况下2.24 L CO时,C电极的质量变化为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中正确的是
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程: 
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为: 2Na2SiO3+2NaAlO2+4H2O===Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:____________。
(2)滤渣A的主要成分________;硅铝酸盐沉淀写成氧化物的形式是________。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是_____________
(4)若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(5)若将铝溶解,下列试剂中最好选用_______(填编号)。
A.浓硫酸 B. 稀硫酸 C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是____,配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.常温常压下,22.4 L乙烯中含C—H键的数目为4NA
B.0.1 mol·L-1的NaHSO4溶液中含有阳离子的总数为0.2NA
C.7.8 g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA
D.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种高分子化合物的结构简式如图所示:
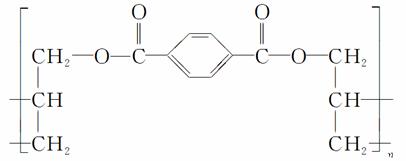
合成它的单体可能有:①对苯二甲酸 ②对苯二甲酸甲酯 ③丙烯醇 ④丙烯 ⑤乙烯。其中正确的一组是( )
A.①② B.④⑤
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用双线桥表示铜与稀硝酸反应电子转移的方向和数目_____________
________________________________________________________________________。
(2)该反应的氧化剂是__________(填化学式),氧化产物与还原产物的物质的量之比为____________。
(3)已知实验室中只有16 mol·L-1的浓硝酸,若要配制100 mL 0.8 mol·L-1的稀硝酸所需浓硝酸的体积为________mL。定容时由于俯视刻度,则对浓度产生的影响为__________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com