

| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
分析 (1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小;
(4)加入盐酸,Na2S2O3反应生成S沉淀,所以静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(5)硫酸的用量一定,由上述二氧化硫的体积可知,第一份、第二份中海波样品完全反应,生成2.24LL二氧化硫需要海波质量为12.6g×$\frac{2.24L}{1.12L}$=25.2g<28.00,故第三份中硫酸不足,结合反应:S2O32-+2H+=S↓+SO2↑+H2O计算硫酸的物质的量,进而计算硫酸的物质的量浓度.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小,故选:c;
(4)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(5)硫酸的用量一定,由上述二氧化硫的体积可知,第一份、第二份中海波样品完全反应,生成2.24LL二氧化硫需要海波质量为12.6g×$\frac{2.24L}{1.12L}$=25.2g<28.00,故第三份中硫酸不足,生成二氧化硫的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应:S2O32-+2H+=S↓+SO2↑+H2O,可知n(H+)=2n(SO2)=0.2mol,故n(H2SO4)=$\frac{1}{2}$n(H+)=0.1mol,则硫酸的物质的量浓度为$\frac{0.1mol}{0.02L}$=5mol/L,
故答案为:5mol/L.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价、化学计算等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,可以利用总反应的分析,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯 | B. | 1,3-丁二烯 | C. | 丙炔 | D. | 2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
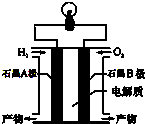 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| B. | A电极是负极,电极上发生氧化反应 | |
| C. | 产物为无污染的水,属于环境友好的绿色电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60mL 稀硫酸标准溶液,配制时应选用100ML容量瓶 | |
| C. | 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | |
| D. | 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| E. | 配制溶液时,定容时俯视度数,则导致实验结果偏大 | |
| F. | 中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
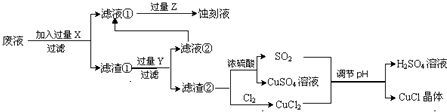
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
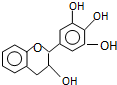 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 一定条件下的氧化产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ds区 | B. | d区 | C. | f区 | D. | s区和p区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com