
����Ŀ�������ʵ�����Ϊ3.00mol����A��B�����5L�����У��������·�Ӧ��3A+B2C���ڷ�Ӧ������C�����ʵ����������¶ȱ仯��ͼ��ʾ��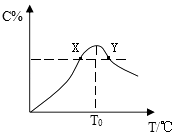
��1��T0��Ӧ�ķ�Ӧ����v������v���棩���á�=����������������ʾ����ͬ����
��2���˷�Ӧ������ӦΪ�ȣ�����š���������
��3��X��Y����A��������Ӧ���ʵĴ�С��ϵ��YX��
��4���¶�T��T0ʱ��C%�������ԭ���ǣ���
��5����Y���C�����ʵ�������Ϊ25%����μӷ�Ӧ��A���ʵ���Ϊmol��
���𰸡�
��1��=
��2����
��3����
��4����Ӧδ��ƽ��,����������Ӧ�����ƶ�
��5��1.8
���������⣺��1����ʼʱ�������ʵ�����Ϊ3.00mol������A��B�������¶ȵ����ߣ���Ӧ������Ӧ������У����¶ȴﵽT0ʱ��C�����ʵ����������˵���ﵽ��Ӧ������ȣ���ƽ��״̬����ʱ���淴Ӧ������ȣ�
���Դ��ǣ�=��
��2�������¶ȵļ������ߣ�C�����ʵ���������С��˵���¶�����ƽ�����ƣ�������ӦΪ���ȷ�Ӧ�����Դ��ǣ��ţ�
��3���¶�Խ�ߣ���Ӧ����Խ��Y���¶ȴ���X�㣬��X�㷴Ӧ����С��Y�㣬
���Դ��ǣ�Y��X��
��4���¶�T0ǰ����Ӧ��û�е���ƽ�⣬��Ӧ������Ӧ���У������¶����ߣ����ɵ�CԽ��Խ�࣬
���Դ��ǣ���Ӧ��û�е���ƽ�⣬��Ӧ������Ӧ���У�
��5����μӷ�Ӧ��A�����ʵ���Ϊx�����ݷ���ʽ֪��ƽ��״̬ʱA�����ʵ���=��3��x��mol��B�����ʵ���=��3�� ![]() ��mol��C�����ʵ���=
��mol��C�����ʵ���= ![]() xmol��C�����ʵ�������=
xmol��C�����ʵ�������= 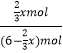 ��100%=25%��x=1.8mol��
��100%=25%��x=1.8mol��
���Դ��ǣ�1.8��
�����㾫�������ջ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A.�Ҵ���ˮ��Һ��ʹ�����ʷ������ʸı�
B.����������һ��������ˮ������������
C.��һ����������֬ˮ������ɸ���
D.ú�ĸ���ʯ�͵ķ������ڻ�ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú��ʯ���п�������������ԭ��A��B��A��һ�ֹ�ʵ����������IJ�����������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��һ�ֱ�ˮ�����״Һ�壬B����̼������Ԫ����ɣ�̼Ԫ������Ԫ�ص�������Ϊ12:1��B����Է�������Ϊ78���ش��������⣺
(1)A�ĵ���ʽ_______��B�Ľṹ��ʽ_____________________��
(2)��A���ڵ�ͬϵ��Cʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ��Ӧ����ʽ��___________________��
(3)�ڵ�ˮ�м���B���ú������________________��
(4)B��Ũ�����Ũ������50��60�淴Ӧ�Ļ�ѧ��Ӧ����ʽ��_____________________________����Ӧ���ͣ�________��
(5)��������A��B��ȫȼ��ʱ����O2�����ʵ���________(��A>B��A<B��A��B��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���PES��֬�Լ����п��������ԵĻ�����K��
��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���PES��֬�Լ����п��������ԵĻ�����K��

��֪:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
��.  (R1��R2��R3��������)
(R1��R2��R3��������)
��1��A��������_________��C�Ĺ����ŵ�������_________��
��2��B����Ϊ��״�ṹ���˴Ź�������ֻ��һ��壬B�Ľṹ��ʽΪ_________ .
��3��E�����к���������������Ϊ˳ʽ�ṹ��E�Ľṹ��ʽΪ_________ .
��4����Ӧ���Ļ�ѧ����ʽΪ_________ ��
��5���Լ�a�Ľṹ��ʽΪ_________����Ӧ�������ķ�Ӧ����Ϊ________��Ӧ��
��6����֪:  ����1��3-����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�
����1��3-����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�![]() �������ºϳ�·�߲�������:_________________
�������ºϳ�·�߲�������:_________________

��7����֪����(-NH2)���ǻ����ƣ�Ҳ�ܷ�����Ӧi������J�Ʊ�K�Ĺ����У��������������L��L����ʽΪC16H13NO3����������Ԫ������L�Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ�
�Իش��������⣺
��1����С�ձ���������ֽ������������
��2�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ�����ƫ����ƫС������Ӱ�족��������ճ������ʵ�ʸ�ʵ��������Ч�����ã�
��3��ʵ���и���60mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ���������ȡ������������ɣ���
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ������50mL 0.5mo1L��1NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�����ƫ����ƫС������Ӱ�족��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У�ʼ���������������
A. NO2ͨ��FeSO4��Һ��B. CO2ͨ��CaCl2��Һ��
C. NH3ͨ��AgNO3��Һ��D. SO2ͨ��Ba��NO3��2��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�A��g��+3B��g�� ![]() 2C��g����ƽ��ı�־�ǣ�������
2C��g����ƽ��ı�־�ǣ�������
A.��λʱ���ڼ���xmolA��ͬʱ����3xmolB
B.��Ӧ���ٽ���
C.��n��A����n��B����n��C��=1��3��2ʱ
D.�����ϵ��ƽ����Է����������ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ�Ⱦ�Ϊ0.1 mol��L��1�������Ϊ100 mL������һԪ��HX��HY����Һ�У��ֱ����NaOH���壬lg![]() �����NaOH�����ʵ����ı仯��ͼ��ʾ(���Լ���NaOH���嵼����Һ�¶�������ı仯)������������ȷ����
�����NaOH�����ʵ����ı仯��ͼ��ʾ(���Լ���NaOH���嵼����Һ�¶�������ı仯)������������ȷ����

A. a����ˮ�������c(H��)��10��12 mol��L��1
B. b��ʱ���ǡ����ȫ�к�
C. c����Һ�У�c(Y��)>c(HY)
D. HX��HY������������HX>HY
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ�Ԫ�أ�Ϊ�˷�ֹ��ȱ���������г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ���ǣ�����Һ�� KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
��1����˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������Ŀ���÷�Ӧ�����������뻹ԭ������������� �� 0.1mol KIO3�μӷ�Ӧʱת�Ƶ���mol
��2��ʵ����������I2��K2SO4��Һ���õ��Լ���
A��Na2SO4��ҺB���ƾ��� C�� CCl4 D��ʳ��ˮ
���õķ��뷽���� �� ���������� �� ����ô�жϸ�ʳ�����Ƿ� ��
��3������ʵ�����õ�һ�����ʵ���Ũ�ȵ�ϡ���ᣬ������1mol/L��ϡ������Һ480mL������18mol/LŨH2SO4mL����������Ҫ�õ�����Ҫ���������ǣ�����ţ� ��
A��100mL��Ͳ ���� B��������ƽ �� C��������D��100mL����ƿ E��50mL ��Ͳ F����ͷ�ι� G���ձ� �� H��500mL����ƿ
��4����������������ϡ������ҺŨ��ƫ�ߵ����� ��
A.�ܽ����Һû����ȴ�����¾�ת��
B.ת��ʱû��ϴ���ձ���������
C.������ƿ��ˮ����ʱ�۾�����Һ��
D.����Ͳ��ȡŨ�����ϴ����Ͳ����ϴ��Һת�Ƶ�����ƿ
E.ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ�����ˮ���̶��ߣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com