
| A. | 先褪色,后复原 | B. | 立即褪色 | C. | 仍为紫色 | D. | 溶液变红色 |
科目:高中化学 来源: 题型:解答题
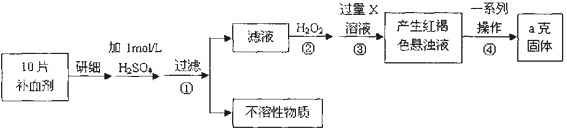
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯能发生加成反应,乙烷不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、H+、SO42- | 少量Ba(OH)2 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B | Fe2+、Cl-、H+ | 少量NaNO3 | 3Fe2++NO3-+4H+═NO↑+2H2O+3Fe3+ |
| C | Na+、Fe3+、NO3- | 过量KSCN | Fe3++3SCN-═Fe(SCN)3↓ |
| D | NH4+、H+、HCO3- | 过量NaOH | NH4++H++HCO3-+3OH-═NH3•H2O+2H2O+CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 分子间作用力越大,分子越稳定 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 原子晶体中共价键越强,熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 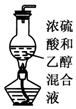 实验室制乙烯 | |
| B. | 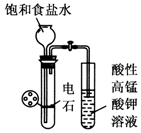 实验室制乙炔并验证乙炔能发生氧化反应 | |
| C. | 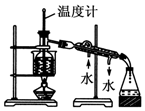 实验室中分馏石油 | |
| D. | 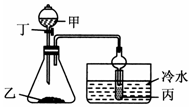 若甲为硫酸,乙为贝壳粉,丙为苯酚钠溶液,验证硫酸、碳酸、苯酚酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
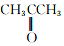
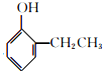 和
和 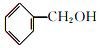
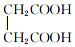 与
与 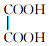
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com