
| A. | 甲烷分子的球棍模型: | |
| B. | 羟基的电子式: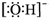 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 中子数为54、质子数为92的铀原子14692U |
分析 A.甲烷的球棍模型用小球和短棍表示, 为甲烷的比例模型;
为甲烷的比例模型;
B.羟基为中性原子团,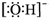 为氢氧根离子;
为氢氧根离子;
C.乙烯的结构简式中没有标出碳碳双键;
D.元素符号的左上角表示的是质量数,该铀(U)原子的中子数为146.
解答 解:A. 为甲烷的比例模型,甲烷的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型为: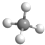 ,故A错误;
,故A错误;
B.氧原子与氢原子通过一对共用电子对连接,羟基中的氧原子含有一个未成对电子,电子式为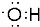 ,故B错误;
,故B错误;
C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;
D.中子数为54、质子数为92的铀(U)原子的质量数为146,该原子可以表示为:92146U,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、比例模型与球棍模型、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
 ,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )
,可由有机化工原料R和其它有机试剂,通过加成、水解、氧化、缩聚反应得到,则R是( )| A. | 1-丁烯 | B. | 乙烯 | C. | 1,3-丁二烯 | D. | 2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 乙烯在空气中燃烧,发生明亮并带有淡蓝色的火焰 | |
| D. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-O-Cl | |
| B. | 比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| D. | NH4Cl的电子式: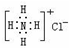 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 族 周期 | IA | 0族 | ||||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
 .
.| 序号 | 条件 | 现象 | 结论 | ||
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com