
 Ӣ
”¢ ”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ²āĮæ¼°“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ唣
”¢COµČ“óĘųĪŪČ¾ĘųĢåµÄ²āĮæ¼°“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ唣 æÉŹ¹
æÉŹ¹ µČŃõ»Æ£¬³£ÓĆÓŚ¶ØĮæ²ā¶ØCOµÄŗ¬Į攣ŅŃÖŖ£ŗ
µČŃõ»Æ£¬³£ÓĆÓŚ¶ØĮæ²ā¶ØCOµÄŗ¬Į攣ŅŃÖŖ£ŗ
 ·“Ӧɜ³É
·“Ӧɜ³É µÄČČ»Æѧ·½³ĢŹ½£ŗ________________”£
µÄČČ»Æѧ·½³ĢŹ½£ŗ________________”£ Ē”ŗĆĶźČ«·“Ӧɜ³ÉÕżŃĪ£¬Ōņ“ĖŹ±ČÜŅŗ³Ź________ŠŌ(Ģī”°Ėį”±»ņ”°¼ī”±)”£
Ē”ŗĆĶźČ«·“Ӧɜ³ÉÕżŃĪ£¬Ōņ“ĖŹ±ČÜŅŗ³Ź________ŠŌ(Ģī”°Ėį”±»ņ”°¼ī”±)”£

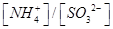 ________2£ØĢī”°£¾”±”°£¼”±»ņ”°£½”±£©
________2£ØĢī”°£¾”±”°£¼”±»ņ”°£½”±£© æÉÓĆĒæ¼īČÜŅŗĪü²śÉśĻõĖįŃĪ”£ŌŚĖįŠŌĢõ¼žĻĀ£¬FeSO4ČÜŅŗÄܽ«
æÉÓĆĒæ¼īČÜŅŗĪü²śÉśĻõĖįŃĪ”£ŌŚĖįŠŌĢõ¼žĻĀ£¬FeSO4ČÜŅŗÄܽ« »¹ŌĪŖNO£¬Š“³öøĆ¹ż³ĢÖŠ²śÉśNO·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________________________”£
»¹ŌĪŖNO£¬Š“³öøĆ¹ż³ĢÖŠ²śÉśNO·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________________________”£ ?H1 +
?H1 + 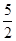 ?H2£¬“ųČėĻą¹ŲŹż¾ŻæɵƓš°ø”£
?H2£¬“ųČėĻą¹ŲŹż¾ŻæɵƓš°ø”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ł¢Ū | B£®¢Ś¢Ü | C£®¢Ś¢Ū | D£®¢Ł¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĪŹ“šĢā
 2SO3(g)µÄĘ½ŗā³£ŹżĪŖ ”£
2SO3(g)µÄĘ½ŗā³£ŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā




 £©”£
£©”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 H[CuCl2]”£·“Ó¦½įŹųŗó½«ČÜŅŗµ¹ČėÕōĮóĖ®ÖŠÓŠCuClÉś³É”£ŹµŃé¹ż³ĢÖŠ¼ÓČėÅØŃĪĖįµÄÄæµÄŹĒ ”£µ±c(Cl-)=2”Į10-3 mol”¤L”Ŗ1Ź±, c(Cu+-)= mol”¤L”Ŗ1”£ŅŃÖŖ£ŗKsp(CuCl)=1.7”Į10-7
H[CuCl2]”£·“Ó¦½įŹųŗó½«ČÜŅŗµ¹ČėÕōĮóĖ®ÖŠÓŠCuClÉś³É”£ŹµŃé¹ż³ĢÖŠ¼ÓČėÅØŃĪĖįµÄÄæµÄŹĒ ”£µ±c(Cl-)=2”Į10-3 mol”¤L”Ŗ1Ź±, c(Cu+-)= mol”¤L”Ŗ1”£ŅŃÖŖ£ŗKsp(CuCl)=1.7”Į10-7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĪüŹÕ183KJ | B£®ĪüŹÕ248KJ | C£®·Å³ö183KJ | D£®·Å³ö366KJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®12¦¤H3+5¦¤H2£2¦¤H1 | B£®2¦¤H1£5¦¤H2£12¦¤H3 |
| C£®12¦¤H3£5¦¤H2£2¦¤H1 | D£®¦¤H1£5¦¤H2£12¦¤H3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com