
| ||

| ||


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
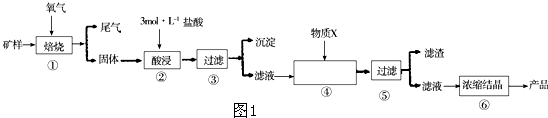
查看答案和解析>>
科目:高中化学 来源: 题型:
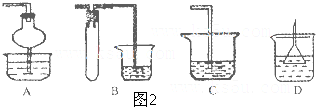
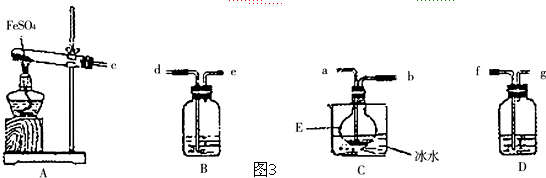
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤编号 | 实验操作 | 预期现象和结论 |
| 1. | 取少量溶液于试管中,滴入 | |
| 2. | 往装有沉淀的试管中加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
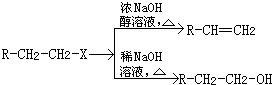
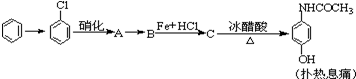
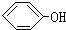 合成
合成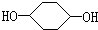 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)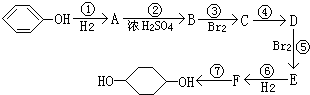
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在中和反应反应热的测定实验中,用温度计轻轻搅拌混合液充分反应后再读数 |
| B、酸碱中和滴定前滴定管和锥形瓶先用滴定液润洗:2~3次 |
| C、配制硫酸亚铁溶液时,将FeSO4固体溶解在稀硫酸中并加人少量铁,再加水进行有关操作 |
| D、某学生用广泛pH试纸测得某稀盐酸的pH为2.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com