
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)恒温下,往一个2 L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
5 min内,消耗N2的平均反应速率为________,此条件下该反应的化学平衡常数K=________;
(2)氨是氮肥工业的重要原料.某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
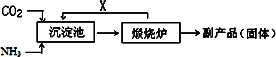
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是________.
②煅烧炉中产生的固态副产品为________,生产流程中能被循环利用的物质X为________.
(3)将SO2通入BaCl2溶液中无明显现象,当通入足量氨气时,则有白色沉淀生成,写出对应的化学方程式________
(4)将浓氨水滴到生石灰上,能快速制得氨气,制取氨气的反应原理为(写出必要的文字说明和化学方程式)________
答案:(1)0.008 mol·L-1·min-1 0.1[或0.1(mol·L-1)-2]
(2)①氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,
增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4
②CaO(或生石灰) CO2(或二氧化碳)
(3)2NH3+SO2+H2O=(NH4)2SO3、(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl
(4)其反应原理为:一是CaO溶于水中,放出大量的热,促进了氨水的分解,二是提供的大量的OH-,使平衡朝着生成NH3的方向移动.涉及的化学方程式为CaO+H2O=Ca(OH)2、NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
解析:(1)V(NH3)=0.08 mol·L-1/5 min,V(N2)=1/2×0.08 mol·L-1/5 min=0.008 mol·L-1·min-1.可通过计算20 min时平衡体系各物质的量浓度为c(NH3)=0.20 mol·L-1、c(N2)=0.40 mol·L-1,c(H2)=1.0 mol·L-1,利用平衡常数公式K=c(NH3)2/c(N2).c(H2)3=0.1
(3)足量NH3与SO2及H2O反应生成亚硫酸铵,亚硫酸铵再与BaCl2溶液反应生成白色沉淀BaSO3.
(4)其反应原理为:一是CaO溶解于水中,和水反应放出大量的热,促进了氨水的分解,有利于氨气放出;二是CaO与水反应生成了Ca(OH)2提供的大量的OH-,使平衡朝着生成NH3的方向移动.涉及的化学方程式:CaO+H2O=Ca(OH)2、NH4++OH-![]() NH3·H2O
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:038
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用.根据题意完成下列计算:
1.由硫与限量氯气在50~60℃反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B.A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71.计算确定这两种氯化物的分子式分别为________.
若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为________.
2.硫的卤化物或卤氧化物都有强水解性,可以作脱水剂.SF4吸收V mL液态水(4℃),完全反应,得到3.2 g SO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为________mL.
3.S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物.一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:
6S2Cl2+16NH3→S4N4+S8+12NH4Cl;
24SCl2+64NH3→4S4N4+S8+48NH4Cl.
S2Cl2、SCl2的混合液体52.86 g溶于足量的CS2中,再通入35.84 L氨气(标准状况)完全氨解,产生14.080 g硫单质.剩余氨气用40 g水完全吸收形成氨水(密度为0.923 g/mL).
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为________.
②所得氨水的物质的量浓度为________(保留1位小数).
4.S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26 K的低温下,可转变为超导体(superconductor).(SN)x的结构式为:

已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物.测得缩合产物中二百聚物的质量分数为0.50.
计算:①缩合产物中各缩合物的物质的量.
②若Ag的实际使用量为8.64 kg,求Ag的循环使用次数.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com