
| A. | 2gD2中所含的电子的数目为2NA | |
| B. | 标况下4.48L CHCl3中所含的原子数目为NA | |
| C. | 4.4g CO2中所含的共用电子对数目为0.2NA | |
| D. | 14 g乙烯和环己烷(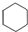 )的混合物中,所含碳原子数为NA )的混合物中,所含碳原子数为NA |
分析 A.n=$\frac{m}{M}$计算物质的量,D2分子中含2个电子;
B.标准状况下三氯甲烷不是气体;
C.n=$\frac{m}{M}$计算物质的量,一个二氧化碳分子中含共用电子对数为四个;
D.乙烯和环己烷( )的最简式相同为CH2,计算14 gCH2中所含碳原子数.
)的最简式相同为CH2,计算14 gCH2中所含碳原子数.
解答 解:A.n=$\frac{m}{M}$计算物质的量=$\frac{2g}{4g/mol}$=0.5mol,D2分子中含2个电子,2gD2中所含的电子的数目=0.5mol×2×NA=NA,故A错误;
B.标准状况下三氯甲烷不是气体,标况下4.48L CHCl3物质的量不是0.2mol,故B错误;
C.n=$\frac{m}{M}$计算物质的量=$\frac{4.4g}{44g/mol}$=0.1mol,一个二氧化碳分子中含共用电子对数为四个,4.4g CO2中所含的共用电子对数目为0.4NA,故C错误;
D.乙烯和环己烷( )的最简式相同为CH2,计算14 gCH2中所含碳原子数=$\frac{14g}{14g/mol}$×NA=NA,故D正确;
)的最简式相同为CH2,计算14 gCH2中所含碳原子数=$\frac{14g}{14g/mol}$×NA=NA,故D正确;
故选D:
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和微粒数的计算、气体摩尔体积应用条件,掌握基础是解题关键,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2是酸性氧化物 | B. | 加热过程中金属元素的化合价升高 | ||
| C. | NO2支持燃烧 | D. | 加热过程中金属元素的化合价降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5x+10 | B. | 5x | C. | 5x+14 | D. | 5x+16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质的电离过程就是产生自由移动离子的过程 | |
| B. | 碳酸钙在水中难溶,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知,C2H4(g)+H2(g)═C2H6(g)△H=-137.0KJ/mol,乙烯与H2加成时放出68.5KJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 100g 17%的H2O2溶液中,极性共价键的数目为NA | |
| D. | 室温下向1L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O、C2H4O2、C6H12O6 | B. | H2、CO、CH3OH | ||
| C. | CH2═CH2、C2H5OH、HOCH2CH2COOH | D. | C6H6、C5H12、C7H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
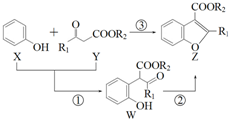 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )| A. | 反应①属于加成反应 | B. | 1molZ完全加成需要3molH2 | ||
| C. | X与W属于同系物 | D. | X、Y、Z、W都能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com