
| A、pH=14的溶液中:K+、Al(OH)4-、SO42- |
| B、水电离出来的c(H+)=10-12mol?L-1的溶液中:K+、Cl-、S2O32- |
| C、有Al3+存在的溶液中:Na+、HCO3-、F- |
| D、滴加甲基橙溶液显红色的溶液中:Ag+、NO2-、ClO3- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
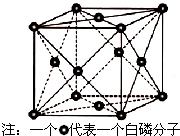 VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是
某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是| A、放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B、充电过程中,a极的反应式为:VO2++2H++e-=VO2++H2O |
| C、充电时,b极接直流电源正极,a极接直流电源负极 |
| D、放电时,当转移1.0 mol电子时共有2.0 mol H+从右槽迁移进左槽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,5.6 g乙烯和环丙烷的混合气体中含有的碳原子数为0.4 NA |
| B、1 mol Cl2通入足量水中反应转移的电子数为NA |
| C、0.1 mol/L Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1 NA |
| D、标准状况下,2.24 L三氯甲烷中含有C-Cl数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br-.S2-.CO32-.K+ |
| B、Na+.NH4+.Cu2+.NO3- |
| C、Na+.K+.I-.Al3+ |
| D、Ba2+.Fe3+.Cl-.AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com