
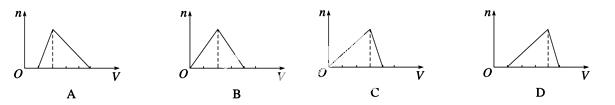
向物质的量浓度均为1 mol·L-1的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,如图中[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是 ( )
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0 min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0 min ~ 2min 内H2的平均反应速率为 。
②达平衡时, CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
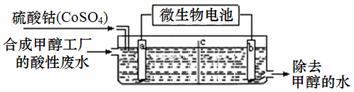
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”, 煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如右图所示:下列说法不正确的是
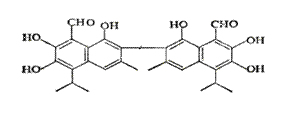
A、该化合物的分子式为:C30H30O8
B、1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C、在一定条件下,可与乙酸反应生成酯类物质
D、该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
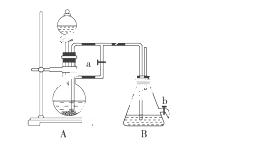
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为____________________.
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是
____________________________________________________________________.
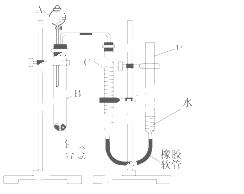
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C 的液面位置;④由A向B中滴加足量试剂;上述操作的顺序是 (填序号);
的液面位置;④由A向B中滴加足量试剂;上述操作的顺序是 (填序号); 记录C的液面位置时,除视线平视外,还应_________________________________________。
记录C的液面位置时,除视线平视外,还应_________________________________________。
(4)B中发生反应的化学反应方程式___________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B 中剩余固体的质量为c g,则铝的相对原子质量为_________________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________.(填“偏大”、“偏小”或“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是: ( )
A.200mL B. 250ml C. 425mL D. 560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②用金属与盐酸反应制得。用以上两种方法都可制得的氯化物是
A. AlCl3 B. FeCl3 C. FeCl2 D. CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是
A.含金属元素的离子一定是阳离子
B.应用蒸馏的方法,可以分离沸点相差较大的液体混合物
C.氯水和过氧化钠都具有漂白作用,其漂白原理相似
D.高炉炼铁时,还原铁矿石的还原剂为一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业残渣主要成分为Fe2O3(含有少量FeO、Cu、Mg等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明:流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+ 生成沉淀而Mg2+不沉淀)
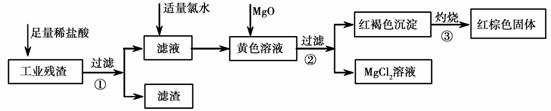
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
A.置换反应 B.化合反应 C.分解反应 D.复分解反应 E.氧化还原反应
(2)加入适量氯水的作用是 ;
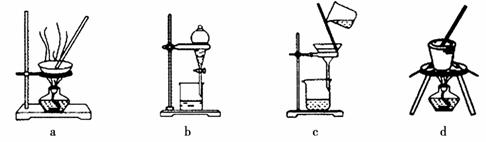
(3)写出灼烧红褐色沉淀时发生反应的化学方程式 。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为 。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中, 。(请补充完整实验操作、现象、结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是__________________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为________________________________________________________________________。
(5)下图中________能较长时间看到Fe(OH)2白色沉淀。
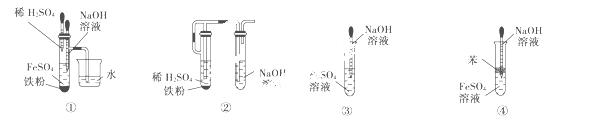
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com