
 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
分析 (1)反应前后离子浓度增加熵变增大,对于吸热反应,温度高,K越大,反之越低,反应自发进行的判断依据是△H-T△S<0;
(2)①Ⅰ.WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq) K1=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$;
Ⅱ.CaWO4(s)?Ca2+(aq)+WO42ˉ(aq) K2 =c(Ca2+)c(WO42-)
Ⅲ.Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq) K3=c(Ca2+)c2(OH-)
依据平衡常数表达式分析判断;
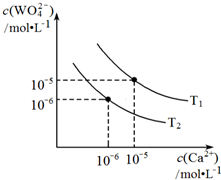
②根据反应Ⅱ,图为不同温度下CaWO4的沉淀溶解平衡曲线,钨酸钙(CaWO4)是微溶电解质,溶解度均随温度升高而减小,结合图象分析判断,T1时Ksp=10-10,T1时,向0.5mol•Lˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,平衡状态下WO42ˉ的浓度=0.5mol-05mol/L×60%=2mol/L,结合溶度积常数计算钙离子浓度;
(3)WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq),
①在反应混合液中不直接通入CO2,是因为二氧化碳和氢氧化钙反应生成更难溶的碳酸根沉淀;
②加入酸性物质和氢氧根离子反应,促进平衡正向进行.
解答 解:(1)WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq),反应前后离子浓度增加熵变增大,△S>0,根据表中温度和K之间的关系,可以看出温度高,K越大,所以反应是吸热的,△H>0,△S>0,满足△H-T△S<0,温度为较高温度下,反应自发进行,
故答案为:>;>;较高;
(2)①Ⅰ.WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq) K1=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$;
Ⅱ.CaWO4(s)?Ca2+(aq)+WO42ˉ(aq) K2 =c(Ca2+)c(WO42-)
Ⅲ.Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq) K3=c(Ca2+)c2(OH-)
依据平衡常数表达式分析判断;K1=$\frac{{K}_{3}}{{K}_{2}}$,
故答案为:K1=$\frac{{K}_{3}}{{K}_{2}}$;
②钨酸钙(CaWO4)是微溶电解质,溶解度均随温度升高而减小,离子浓度可知,T1<T2,结合图象分析判断,T1时Ksp=10-10,T1时,向0.5mol•Lˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,平衡状态下WO42ˉ的浓度=0.5mol-0.5mol/L×60%=0.2mol/L,Ksp=c(Ca2+)c(WO42-)=10-10,
c(Ca2+)=$\frac{1{0}^{-10}}{0.2}$=5×10ˉ10,
故答案为:<; 5×10ˉ10;
(3)WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq),
①在反应混合液中不直接通入CO2,是因为二氧化碳和氢氧化钙反应生成更难溶的碳酸根沉淀,在反应混合液中不直接通入CO2,其理由是:碱性条件下CO2与Ca2+生成难溶物CaCO3,降低WO42ˉ的转化率,
故答案为:碱性条件下CO2与Ca2+生成难溶物CaCO3,降低WO42ˉ的转化率;
②WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq),反应中加入酸性物质和氢氧根离子反应,促进平衡正向进行,加入酸性物质与OHˉ反应,使溶液中OHˉ浓度减小,平衡向生成CaWO4的方向移动,
故答案为:加入酸性物质与OHˉ反应,使溶液中OHˉ浓度减小,平衡向生成CaWO4的方向移动.
点评 本题考查了化学平衡影响因素、平衡常数、溶度积常数的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与K2CO3;HNO3与Na2CO3 | B. | CH3COOH与KOH;HCl与NaOH | ||
| C. | BaCl2与Na2SO4;Ba(OH)2与(NH4)2SO4 | D. | HCl与Na2CO3;HCl与NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com