
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA个 | |
| B. | 500mL 1moL/L的盐酸溶液中含有的HCl分子数为0.5 NA个 | |
| C. | 将1L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA个 | |
| D. | 23gNa与O2反应生成Na2O和Na2O2的混合物,转移的电子数为 NA个 |
分析 A、标况下四氯化碳为液态;
B、盐酸溶液中无HCl分子;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析.
解答 解:A、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、HCl的水溶液称为盐酸,但HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于2NA个,故C错误;
D、23g钠的物质的量为1mol,而反应后钠元素变为+1价,故1mol钠转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成1molAlN需转移6mol电子 | |
| C. | AlN属于离子化合物,其中氮元素的化合价为+3 | |
| D. | AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同原子构成的物质可能是单质、化合物或混合物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| B. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| C. | 平衡时,其它条件不变,分离出少量的硫,正反应速率不变 | |
| D. | 平衡时,其他条件不变,升高温度可使反应速率加快,平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
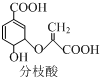
| A. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3molNaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 B
B D
D .写出D→E的反应的化学方程式
.写出D→E的反应的化学方程式 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com