
| A、常温常压下,22.4 L的氧气含氧原子数为2NA |
| B、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| C、常温下,23g NO2含有NA个氧原子 |
| D、足量铜与1L 18mol?L-1浓硫酸反应可以得到SO2的分子总数为9NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、a>b>c>d |
| B、a>c>d>b |
| C、c>a>b>d |
| D、b>d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该装置将化学能转变为电能 |
| B、溶液中的阳离子向锌电极移动 |
| C、Cu极上有气泡产生,发生还原反应 |
| D、电流方向是从铜片流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
B、 如图装置可用于干燥、收集氨气,并吸收多余的氨气 |
C、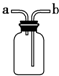 如图装置可用于排空气法收集NO2气体 |
D、 如图装置可用于证明Cl2易与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |
| 化学键 | H-H | Cl-Cl | H-Cl |
| 生成1mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(H2)c(CO) |
| c(H2O) |
| T/K | 300 | 400 | 500 | … |
| K/(mol?L-1 )-2 | 4×106 | 8×107 | 1.2×109 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2L溶液中含有0.6NA个S
| ||
| B、2L溶液中K+离子的浓度为1.2mol/L | ||
| C、1L溶液中含K+离子的质量是23.4g | ||
| D、1L溶液中含溶质阴阳离子的总数为0.9NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com