
| A. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| B. | 25℃、1.01×105 Pa下,44g CO2中含有的原子数为3NA | |
| C. | 1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA |
分析 A.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B.依据n=$\frac{m}{M}$结合1个二氧化碳分子含有3个原子解答;
C.碳酸根离子为弱酸根离子,水溶液中部分水解;
D.铁与氯气反应生成氯化铁,氯气不足依据氯气的量计算转移电子数.
解答 解:A.胶体中胶粒是多个Fe(OH)3的聚合体,所以1molFeCl3完全转化为Fe(OH)3胶体后生成小于NA个胶粒,故A错误;
B.25℃、1.01×105 Pa下,44g CO2物质的量为$\frac{44g}{44g/mol}$=1mol,含有的原子数为3NA,故B正确;
C.碳酸根离子为弱酸根离子,水溶液中部分水解,所以1 L 0.5mol/L Na2CO3 溶液中含有的CO32-数目小于0.5NA,故C错误;
D.1 mol Cl2与足量Fe反应生成氯化铁,生成2mol氯离子,转移的电子数为2NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意盐类水解规律,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个-CH3,能生成3种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成2种一氯代物 | D. | 4个-CH3,能生成2种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,由H2O2制得2.24L O2转移的电子数为0.4NA | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | NO2和H2O反应生成2mol HNO3时转移的电子数为4NA | |
| D. | 常温常压下,11.2L NH3中所含氮原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
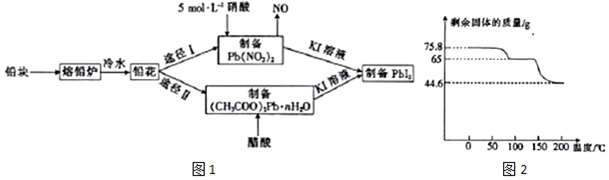
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
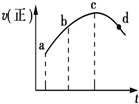 将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )
将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )| A. | 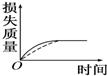 | B. | 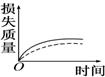 | C. | 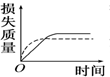 | D. | 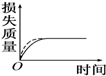 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 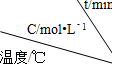 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
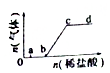 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com