一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.
(1)原NaOH溶液的质量分数为______.
(2)所得溶液中Cl-的物质的量为______mol.
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=______.
【答案】
分析:(1)m(NaOH)=n(NaOH)×M(NaOH),m(溶液)=vρ,根据质量分数=

计算;
(2)根据电荷守恒计算;
(3)由题意可知氯气过量,反应后所得混合物为HCl和Cl
2,涉及反应有HCl+NaOH=NaCl+H
2O、Cl
2+2NaOH=NaCl+NaClO+H
2O,根据质量守恒计算.
解答:解:(1)m(NaOH)=n(NaOH)×M(NaOH)=0.1L×3mol/L×40g/mol=12g,
m(溶液)=vρ=100mL×1.12g/mL=112g,
则ω(NaOH)=
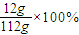
=10.71%,
故答案为:10.71%;
(2)所得溶液中为NaCl和NaClO的混合物,根据电荷守恒可知n(Na
+)=n(Cl
-)+n(ClO
-),
则n(Cl
-)=n(Na
+)-n(ClO
-)=0.3mol-0.05mol=0.25mol,
故答案为:0.25;
(3)由题意可知氯气过量,反应后所得混合物为HCl和Cl
2,
涉及反应有HCl+NaOH=NaCl+H
2O、Cl
2+2NaOH=NaCl+NaClO+H
2O,
据反应可知,燃烧后剩余Cl
2为
n(Cl
2)
余=
n(NaClO)=0.05 mol,
与H
2反应的Cl
2为n(Cl
2)=

×[n(Cl
-)-n(NaClO)]=

×(0.25mol-0.05mol)=0.1mol=n(H
2),
则所用氯气和参加反应的氢气的物质的量之比n(Cl
2):n(H
2)=(0.1mol+0.05mol):0.1mol=3:2,
故答案为:3:2.
点评:本题考查较为综合,侧重于学生计算能力和分析能力的考查,注意判断反应的程度以及相关方程式的书写,从质量守恒的角度解答该题.

 计算;
计算;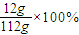 =10.71%,
=10.71%, ×[n(Cl-)-n(NaClO)]=
×[n(Cl-)-n(NaClO)]= ×(0.25mol-0.05mol)=0.1mol=n(H2),
×(0.25mol-0.05mol)=0.1mol=n(H2),
