
分析 根据烷烃的摩尔质量M=ρVm求出相对摩尔质量,利用摩尔质量和相对分子质量在数值上相等,求出相对分子质量,根据含碳量可计算含氢量,进而计算分子中碳、氢原子的个数,由此写出有机物的分子式.
解答 解:(1)某烃的摩尔质量M=2.59g/L×22.4L/mol=58g/mol,
1mol 某烃中含C:$\frac{58×82.76%}{12}$═4,
1mol 某烃中含H:$\frac{58(1-82.76%)}{1}$═10,
故某烃的分子式为:C4H10,
故答案为:58 g/mol;C4H10;
(2)若该有机物分子结构中含有2个甲基,其结构简式为CH3CH2CH2CH3,故答案为:CH3CH2CH2CH3.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握计算的思路和方法.


科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
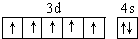 ,在其化合物中,最高正价是+7;
,在其化合物中,最高正价是+7;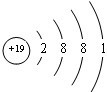 ;
; ;
;查看答案和解析>>
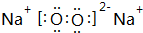
科目:高中化学 来源: 题型:解答题
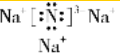 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
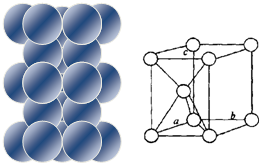 | (1)镁原子在二维空间的配位数为6 (2)位于晶胞中部的镁原子与离它最近两平面相切(填“相离”或“相切”或”相交”) |
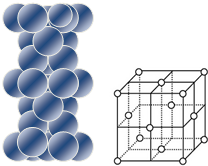 | (3)铜原子在三维空间的配位数为12 (4)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性和咸的食物 | |
| C. | 用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com