
【题目】在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A. Vd/(MV+2240)mol/LB. 1000Vd/(MV+2240)mol/L
C. VdM/(MV+2240)mol/LD. VM/22.4(V+0.1)mol/L
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
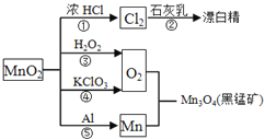
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究构成原电池的条件,装置如图:
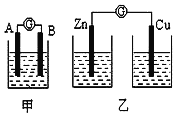
实验一:实验探究电极的构成(甲图)
①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。
结论一: _________________________________;
实验二:探究溶液的构成(甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转。
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生;
结论二: __________________________________________;
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转.
结论三: _________________________________________ ;
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若A为镁片,B为铝片,电解质溶液为NaOH溶液;负极为_______(填“A”或“B”);电流计的指针应向_______偏转(填“右”或“左”)。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 1mol联氨(N2H4)中含有5mol共价键
C. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下:
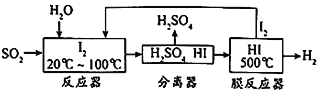
下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2 == H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmL Al2(SO4)3溶液中,含有Al3+a g,取V/2 mL溶液稀释到3V mL,则稀释后溶液中SO42-的物质的量浓度是
A. 250a/27V mol·L﹣1B. 250a/27V mol·L﹣1
C. 500a/9V mol·L﹣1D. 125a/27V mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构。关于该化合物的说法不正确的是( )
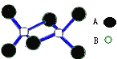
A. 化学式是Al2Cl6
B. 不存在离子键和非极性共价键
C. 在固态时所形成的晶体是分子晶体
D. 是离子化合物,在熔融状态下能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
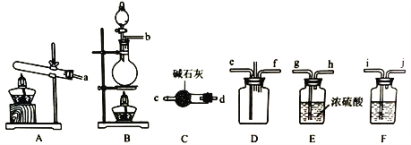
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的离子方程式____________
(2)确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置F中试剂的作用为___________
(4)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化铵固体可能会堵塞导管,之二为:___________。
II.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用右图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。
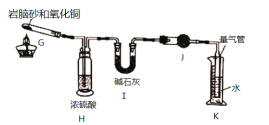
(5)写出G中发生反应的方程式______________________________________________
(6)若没有H装置,会导致测量值_____________(填“偏高”,“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
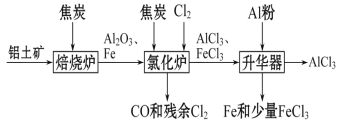
已知:AlCl3、FeCl3分别在183 ℃、315 ℃时升华
(1)铝原子的结构示意图为________,实验室配制氯化铝溶液时加入盐酸的目的是________________________。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为______________________炉气中残余有少量Cl2,请画出吸收Cl2的尾气装置图_____。

(3)700 ℃时,升华器中物质经充分反应后需降温实现FeCl3和AlCl3的分离。请选择合适的温度范围________________。
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(4)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
m克样品![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() n克Al2O3
n克Al2O3
NaAlO2溶液与过量二氧化碳反应的离子方程式为:______________________。计算该样品中Al的质量分数________(结果用m、n表示,不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com