
分析 酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大;
强酸强碱盐溶液呈中性;溶液导电能力与溶液中离子浓度成正比,据此判断四种酸的酸性强弱.
解答 解:酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,说明酸性强弱:HB>HD;
强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,NaA溶液呈中性,说明HA为强酸;
溶液导电能力与溶液中离子浓度成正比,同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,说明HC溶液中离子浓度大于HB,且二者浓度相等,所以酸性:HC>HB,
通过以上分析知,这四种酸强弱顺序是HA>HC>HB>HD,
故答案为:HA>HC>HB>HD.
点评 本题考查酸性强弱判断,明确酸的酸性强弱与酸根离子水解程度的关系是解本题关键,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题

| A. | M与A均能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | B能发生消去、氧化、取代、缩聚等反应 | |
| C. | 1molM与足量烧碱溶液反应,可消耗2nmolNaOH | |
| D. | A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
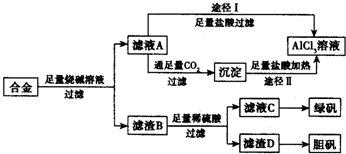 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50s的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3 和0.20mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由红外光谱可知,该有机物的结构简式为CH3OH | |
| B. | 由核磁共振氢谱可知,该有机物分子中有3个氢原子 | |
| C. | 综合上述两种谱图分析,可以得知其A的相对分子质量 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com