
【题目】某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:已知:AgSCN为白色难溶物。下列说法不正确的是( )

A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
![]()
![]()
C.②中发生了氧化还原反应
D.对于②中红色褪去的原因可能与平衡移动原理有关
【答案】D
【解析】
A.硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为Ag2SO4,故A正确;
B.向①的试管中滴加0.5mol/L KI溶液,有黄色沉淀生成,是硫酸银转化为AgI,发生的是沉淀转化,反应的离子方程式为Ag2SO4(s)+2 I-2AgI(s)+SO42-,故B正确;
C.②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,试管壁有银析出,可能发生的离子反应是银离子氧化亚铁离子为铁离子,银离子被还原为银单质,反应的离子方程式为Ag++Fe2+=Ag+Fe3+,②发生了氧化还原反应,故C正确;
D.取上层清液,滴加KSCN溶液,产生白色沉淀,溶液局部变红色,振荡后红色褪去,沉淀量增加,若与平衡移动有关,那么局部溶液发生反3SCN-+Fe3+Fe(SCN)3,当振荡试管时,溶液中过量银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行,溶液红色会变淡,但不至于消失,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是( )
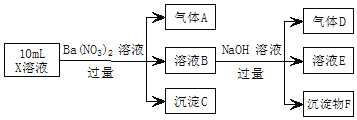
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月21日是第二十七届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:
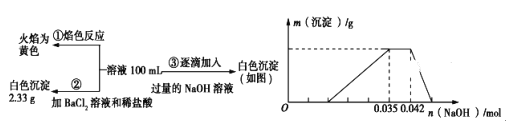
请回答下列问题:
(1)焰色反应是_________ (填“物理”或“化学”)变化;实验②中产白色沉淀是_________ (填化学式)。
(2)原溶液中一定存在的离子有________________,可能存在的离子有________________,一定不存在的离子有________________ (写化学式)。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________________
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?________________(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B.0.1 mol Zn与含0.1 mol HCl的盐酸充分反应,生成H2的体积为112mL
C.常温常压下,3.2 g O2所含的原子数为0.2NA
D.标准状况下,2.24 LH2O含有的H2O分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是
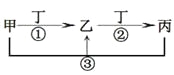
A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+)
D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属加工厂排放的污水中含有CuSO4、ZnSO4、FeSO4,某研究小组利用该污水回收工业重要原料硫酸锌和有关金属,其流程如下:
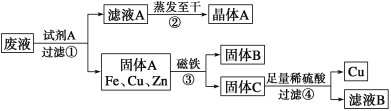
请回答下列问题:
(1)下列说法正确的是________。
A.该工艺流程中发生了3个置换反应
B.CuSO4与Mg(OH)2发生复分解反应可得Cu(OH)2
C.步骤①②③④都包含化学变化
(2)写出步骤①发生反应的离子方程式:__________________、_________________
(3)步骤④中加入足量稀硫酸的目的是________________
(4)滤液B含有的分散质为____________、___________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
A.恒容,按原平衡各物质的比例充入N2、O2和NOB.恒容,充入He
C.恒压,充入HeD.恒压,充入N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com